题目内容
【题目】某工厂车间以MnO2为原料制备高纯MnCO3的流程如下。下列说法正确的是( )
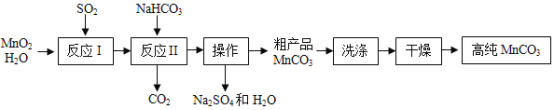
已知:①反应I的化学方程式:MnO2+SO2=MnSO4;
②MnCO3、Mn(OH)2均难溶于水,MnCO3在100°C时开始分解。
A.反应I中只有Mn元素的化合价发生了改变
B.反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有Mn(OH)2
C.为快速获得高纯MnCO3,需选择干燥的条件是高于100°C
D.若原料MnO2有8.7kg,假设其它原料都足量,实验过程无损失,最终得到的产品中含11.5kgMnCO3
【答案】BD
【解析】
A、反应I的化学方程式:MnO2+SO2=MnSO4;锰元素的化合价由+4价变为+2价,硫元素的化合价由+4价变为+6价;故选项错误;
B、反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有Mn(OH)2因为:MnCO3、Mn(OH)2均难溶于水;故选项正确;
C、为快速获得高纯MnCO3,需选择干燥的条件是低于100°C,因为:MnCO3在100°C时开始分解;故选项错误;
D、若原料MnO2有8.7kg,假设其它原料都足量,实验过程无损失,若原料MnO2有8.7kg,则锰元素的质量=8.7kg×![]() ;最终得到的产品中含MnCO3的质量=
;最终得到的产品中含MnCO3的质量=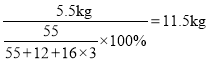 ;故选项正确;
;故选项正确;
故选:BD。

练习册系列答案
相关题目