题目内容
【题目】下图是实验室制取气体的装置图(固定装置省略),请回答下列问题:
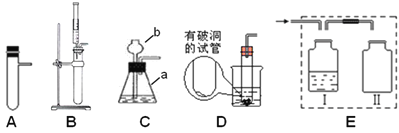
(1)仪器名称:a____________。
(2)B图的装置可用来制取氧气,写出制取该气体的化学方程式: ____________,
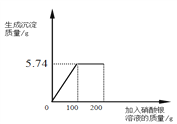
若用E收集一瓶干燥的氧气,其中Ⅰ瓶中盛放的试剂是________(填名称),并将图E补充完整___。
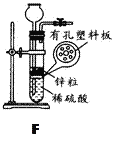
(3)实验室用锌粒与稀硫酸反应制取氢气,发生装置如F图所示。打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,则下列溶液中,最适宜从长颈漏斗中添加的是_________(填字母)。
A.氢氧化钠溶液 B.碳酸钠溶液 C.硫酸钠溶液 D.澄清石灰水
(4)小明同学设计了如下图所示的实验装置,既可用于制取CO2,又可用于探究CO2的性质。
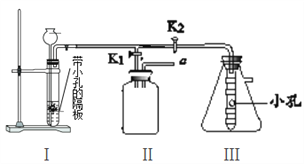
说明:①装置Ⅰ中盛放的药品是石灰石和稀盐酸。
②装置Ⅲ中在小试管外壁贴有4片试纸:其中两端的两片用紫色石蕊溶液润湿,中间两片用紫色石蕊溶液浸过并晒干。
a.实验时,打开K1关闭K2可用来制取CO2。装置Ⅰ中发生的化学反应的基本反应类型为__________,装置Ⅰ的优点是___________________________;若用排空气法收集CO2,请将图Ⅱ补充完整____;若在Ⅱ中放入_________,还可用于检验CO2。
b.实验时,关闭K1打开K2可用于探究CO2的性质。实验时Ⅲ中出现的现象是_________。
【答案】 锥形瓶 2H2O2![]() 2H2O+O2↑ 浓硫酸
2H2O+O2↑ 浓硫酸  C 复分解反应 控制反应的开始和停止
C 复分解反应 控制反应的开始和停止 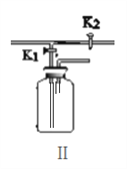 澄清石灰水 干燥试纸无变化,湿润试纸由下至上依次变红
澄清石灰水 干燥试纸无变化,湿润试纸由下至上依次变红
【解析】(1). 锥形瓶 (2).过氧化氢在二氧化锰的作用下分解生成氧气和水,反应方程式为: 2H2O2![]() 2H2O+O2↑ (3). Ⅰ瓶中盛放的试剂是干燥剂浓硫酸 (4). 干燥时气体应该从长管进短管出,收集时导管应伸到接近瓶底。
2H2O+O2↑ (3). Ⅰ瓶中盛放的试剂是干燥剂浓硫酸 (4). 干燥时气体应该从长管进短管出,收集时导管应伸到接近瓶底。 (5).氢氧化钠溶液 碳酸钠溶液.澄清石灰水都能与硫酸反应,,所以应加入硫酸钠。
(5).氢氧化钠溶液 碳酸钠溶液.澄清石灰水都能与硫酸反应,,所以应加入硫酸钠。
(6). 由两种化合物相互交换成分形成两种新的化合物的反应叫复分解反应。 (7). 关闭弹簧夹,大试管内气体增多,压强变大,在压力的作用下,试管内液面下降,当液面下降到隔板下边时,固体反应物与液体分离,反应停止;反之,打开弹簧夹,反应开始。(8). 二氧化碳的密度比空气大,应该从长管进入。 (9).常用澄清石灰水检验二氧化碳,澄清石灰水变浑浊证明气体是二氧化碳。 (10). 二氧化碳和水生成碳酸,二氧化碳密度比空气大,使紫色石蕊试液变红,所以干燥试纸无变化,湿润试纸由下至上依次变红
(9).常用澄清石灰水检验二氧化碳,澄清石灰水变浑浊证明气体是二氧化碳。 (10). 二氧化碳和水生成碳酸,二氧化碳密度比空气大,使紫色石蕊试液变红,所以干燥试纸无变化,湿润试纸由下至上依次变红

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】铜片在潮湿的空气中久置,表面会产生绿色的铜锈。某小组同学设计并进行实验,探究铜生锈的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与铜片接触的物质,利用下图装置(铜片长度为3 cm,试管容积为20 mL)分别进行下列5个实验,并持续观察30天。
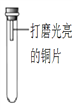
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气 再加入2 mL浓硫酸 | 铜片始终无明显变化 |
2 | 先加入4 mL饱和Na2SO3溶液 再充满CO2 | 铜片始终无明显变化 |
3 | 加入2 mL NaOH浓溶液 | 铜片始终无明显变化 |
4 | 先加入2 mL浓硫酸 再通入约4 mL CO2 | 铜片始终无明显变化 |
5 | 先加入2 mL蒸馏水 再通入约4 mL CO2 | 铜片表面变成绿色 |
【解释与结论】
(1)实验中,NaOH浓溶液的作用是___________(用化学方程式表示)。
(2)实验1的目的是________。
(3)实验2中,试管内的气体主要含有CO2、________。
(4)得出“铜生锈一定与H2O有关”的结论,依据的两个实验是________(填编号)。
(5)由上述实验可推知,铜片生锈的条件是_________________。
【反思与评价】
(6)在猜想与假设时,同学们认为铜生锈与N2无关,其理由是________。
(7)兴趣小组的同学认为不需进行上述实验,他们向铜锈中加入稀盐酸并把生成的气体通入___。