题目内容
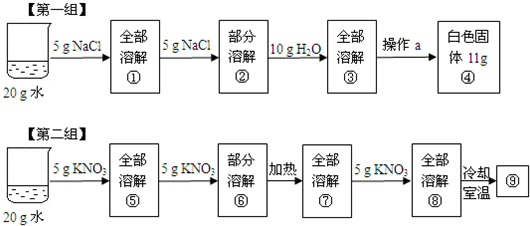
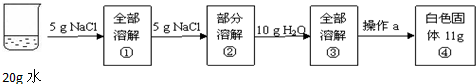
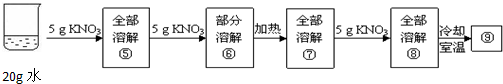
某兴趣小组为了研究NaCl和KNO3的溶解和结晶,做了两组实验(室温下),其过程如下:[第一组]
[第二组]
(1)①中溶质的质量分数为
(2)第一组实验中操作a为
A.溶解NaCl固体时,没有用玻璃棒搅拌.
B.称量5g NaCl固体后,称量纸上仍留有固体.
C.蒸发时,未及时停止加热,有固体溅出.
D.蒸发后所得NaCl 固体中仍含有水分.
(3)上述实验过程中一定属于饱和溶液的是(填数字序号,下同)
分析:(1)根据溶质的质量分数=
×100%来计算;
(2)从溶液中析出晶体,采用蒸发的方法;
(3)根据饱和溶液和不饱和溶液的概念结合图象可以实验过程中所得溶液是否达到饱和.
| 溶质的质量 |
| 溶液的质量 |
(2)从溶液中析出晶体,采用蒸发的方法;
(3)根据饱和溶液和不饱和溶液的概念结合图象可以实验过程中所得溶液是否达到饱和.
解答:解:
(1)①中溶质的质量分数=
×100%=20%;氯化钠的溶解度随温度的降低而降低,冷却至室温,有白色固体析出;
(2)把氯化钠从它的溶液中析出,采用蒸发的方法;
所得氯化钠固体质量为11g,大于10g可能原因为D(蒸发所得的氯化钠固体中仍含有水分),
A、玻璃棒的作用是加速溶解,与氯化钠的质量无关,B、称量纸上仍有固体,会使氯化钠质量减少,C、蒸发时有固体溅出,使固体质量减少,D、蒸发所得固体仍含有水分,会使所得固体质量增加,故选D.
(3)确定溶液是否饱和,关键要看该温度下能否继续溶解该溶质,不能继续溶解是饱和溶液,能继续溶解是不饱和溶液.②⑥⑨中均有不能继续溶解的溶质存在,故上述实验过程中所得溶液一定达到饱和的是②⑥⑨;①和⑤中10g水中溶解的溶质相等,故溶质质量分数一定相等;⑥、⑨都是该温度下硝酸钾的饱和溶液,故溶质质量分数一定相等.
故答案为:
(1)20%,析出白色固体;
(2)蒸发,D;
(3)②⑥⑨,①和⑤(或⑥和⑨).
(1)①中溶质的质量分数=
| 5g |
| 20g+5g |
(2)把氯化钠从它的溶液中析出,采用蒸发的方法;
所得氯化钠固体质量为11g,大于10g可能原因为D(蒸发所得的氯化钠固体中仍含有水分),
A、玻璃棒的作用是加速溶解,与氯化钠的质量无关,B、称量纸上仍有固体,会使氯化钠质量减少,C、蒸发时有固体溅出,使固体质量减少,D、蒸发所得固体仍含有水分,会使所得固体质量增加,故选D.
(3)确定溶液是否饱和,关键要看该温度下能否继续溶解该溶质,不能继续溶解是饱和溶液,能继续溶解是不饱和溶液.②⑥⑨中均有不能继续溶解的溶质存在,故上述实验过程中所得溶液一定达到饱和的是②⑥⑨;①和⑤中10g水中溶解的溶质相等,故溶质质量分数一定相等;⑥、⑨都是该温度下硝酸钾的饱和溶液,故溶质质量分数一定相等.
故答案为:
(1)20%,析出白色固体;
(2)蒸发,D;
(3)②⑥⑨,①和⑤(或⑥和⑨).
点评:本题难度不大,主要考查了固体溶解度的意义,通过本题可以加强学生对饱和溶液的理解,培养学生应用知识解决问题的能力.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
 27、如图是氯化钠和硝酸钾两种固体物质的溶解度曲线.
27、如图是氯化钠和硝酸钾两种固体物质的溶解度曲线.