题目内容
【题目】某校兴趣小组收集到两种岩石样品A和B.他们进行了如下实验探究(B是常用的建筑材料,H是单质,图中部分产物被略去):
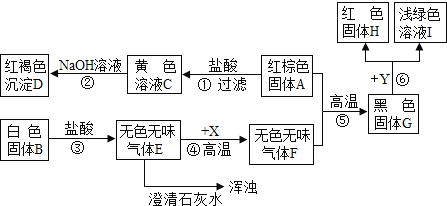
(1)写出有关物质的化学式:
A的主要成分_____,B的主要成分_____,E_____,Y_____。
(2)写出图中下列步骤的化学方程式:
①_____②_____
⑤_____⑥_____。
【答案】Fe2O3 CaCO3 CO2 CuSO4 Fe2O3+6HCl═2FeCl3+3H2O 3NaOH+FeCl3═Fe(OH)3↓+3NaCl Fe2O3+3CO![]() 2Fe+3CO2 Fe+CuSO4=FeSO4+Cu。
2Fe+3CO2 Fe+CuSO4=FeSO4+Cu。
【解析】
B是常用的建筑材料,B和盐酸反应会生成无色气体,所以B的主要成分是碳酸钙,碳酸钙和盐酸反应会生成氯化钙、水和二氧化碳,所以E是二氧化碳,二氧化碳能使石灰水变浑浊,二氧化碳和X高温会生成无色无味的气体F,所以F是一氧化碳,D是红褐色沉淀,所以D是氢氧化铁,C就是氯化铁,A的主要成分是氧化铁,氧化铁和一氧化碳高温会生成铁和二氧化碳,所以G就是铁,I是浅绿色溶液,所以I中有亚铁离子,铁和Y会生成亚铁离子和红色单质H,所以Y是铜盐,H就是铜,经过验证,推出的各种物质均满足题中的转化关系,推导合理。
(1)A的主要成分是Fe2O3,B的主要成分是CaCO3,E是二氧化碳,Y是铜盐,如CuSO4;
(2)反应①是氧化铁和盐酸反应生成氯化铁和水,故化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;
反应②是氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠,故化学方程式为:3NaOH+FeCl3═Fe(OH)3↓+3NaCl;
反应⑤是一氧化碳和氧化铁高温生成铁和二氧化碳,故反应的方程式为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
反应⑥是铁和硫酸铜反应生成硫酸亚铁和铜。故反应的方程式为:Fe+CuSO4=FeSO4+Cu;

【题目】为测定久置于空气中的氢氧化钠样品的变质程度,某化学活动小组称取该固体样品6.5g放入锥形瓶中,加水溶解,配成50g溶液,再向锥形瓶中滴加稀硫酸,反应过程中产生气体质量的部分实验数据和锥形瓶中溶液质量变化的图象如表所示:
加入稀硫酸的质量/g | 40 | 65 | 75 |
产生气体的质量/g | 1.1 | 2.2 | 2.2 |
(1)6.5g样品与稀硫酸完全反应产生气体的质量是________g。
(2)6.5g样品中碳酸钠的质量分数是________。(结果精确至0.1%)
(3)以上三次的实验数据中,只有一次加入的稀硫酸与锥形瓶中溶液的溶质恰好完全反应。
①如图图象中a的数值是________。
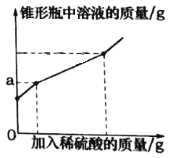
②求该实验中所用稀硫酸的溶质质量分数____。(写出计算过程)