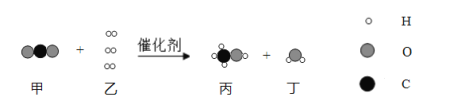
题目内容
【题目】黄铜(铜锌合金)的外观与黄金极为相似、容易以假乱真。小红同学想测定黄铜中锌的含量。她称取20g黄铜样品放入烧杯中,加入足量稀硫酸充分反应后,测得生成氢气的质量为0.2g。
(1)该反应属于____________(填基本反应类型)。
(2)求黄铜样品中锌的质量分数为________(写计算过程)。
【答案】 置换反应 32.5%
【解析】(1)根据锌的金属活动性比氢强,能置换出稀硫酸中的氢解答;(2)根据反应的化学方程式计算解答。(1)锌的金属活动性比氢强,能置换出稀硫酸中的氢,符合“一换一”的特征,故该反应属于置换反应;(2)设样品中锌的质量为x。
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.2g
![]()
x=6.5g
黄铜样品中锌的质量分数为![]() ×100%=32.5%
×100%=32.5%
答:黄铜样品中锌的质量分数为32.5%。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目