题目内容
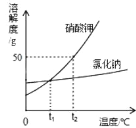
【题目】某同学利用石灰石样品和稀盐酸进行如下实验,操作过程和数据如图(样品中杂质不与酸反应也不溶于水)。
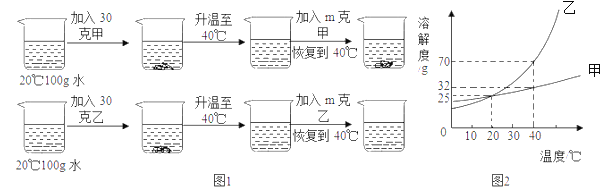
(1)生成二氧化碳的质量为_____
(2)试计算石灰石样品中碳酸钙的质量分数____。

【答案】5.28g 80%
【解析】
石灰石的主要成分碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,根据质量守恒定律,烧杯内质量的减少的质量即生成的二氧化碳质量,据此根据反应的化学方程式列式计算出参加反应碳酸钙的质量,进而计算出石灰石样品中碳酸钙的质量分数。
解:(1)由质量守恒定律,生成二氧化碳的质量为15g+100g-109.72g=5.28g;
(2)设参加反应的碳酸钙的质量为x,

![]()
x=12g,
石灰石样品中碳酸钙的质量分数为![]() ×100%=80%;
×100%=80%;
答:(1)生成二氧化碳的质量为5.28g;
(2)石灰石样品中碳酸钙的质量分数为80%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】下列有关化学实验的“操作——现象——结论”的描述都正确的是
选项 | 操作 | 现象 | 结论 |
A | 将高锰酸钾固体充分加热 | 固体全部消失 | 高锰酸钾易分解 |
B | 将砂纸打磨过的铝丝浸入硫酸铜溶液中 | 铝丝表面有铜析出 | 铝比铜活泼 |
C | 将一氧化碳气体通过灼热的氧化铜 | 黑色粉末变红 | 一氧化碳具有还原性 |
D | 将集满二氧化碳的试管倒置于水槽中 | 试管中水面上升 | 二氧化碳能溶于水 |
A. A B. B C. C D. D