题目内容
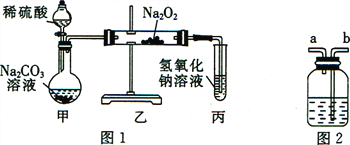
【题目】某化学兴趣小组的同学为探究过氧化钠与二氧化碳反应的产物,用如下图所示的装置进行实验。
【查阅资料】
2Na2O2+2H2O=4NaOH+O2↑
4NaO2+2CO2=2Na2CO3+3O2↑
(1)打开分液漏斗的活塞,烧瓶中发生的现象是___________,过一会儿关闭活塞;为检验反应中是否有氧气生成,应将___________插入试管丙中,观察其是否复燃。
【进行探究】乙中玻璃管所得固体成分的探究
【猜想与假设】
小红认为是碳酸钠;小明认为是氢氧化钠;小华认为是碳酸钠和氢氧化钠的混合物。
【设计并进行实验】
(2)小燕同学将少量白色固体放人烧杯中,加水搅拌使其溶解,取溶解后的溶液进行实验。

_________________________ _______________________
于是小燕同学得出白色固体是碳酸钠和氢氧化钠的混合物的结论。
【交流讨论】
(3)小明同学认为玻璃管固体成分中含有氢氧化钠的理由是_____________。为此他认为应该在甲、乙装置之间增加图2装置,其中存放的试剂为______________
(4)小组的其他同学对小燕的结论提出了质疑,认为溶液呈碱性不一定含有NaOH,理由是__________,请你设计实验验证白色固体中是否含有氢氧化钠:________________
【答案】 有大量气泡产生 带火星的木条 Na2 CO3 Na2 CO3+BaCl2=2NaCl+BaCO3 ↓ 溶液变红色 稀硫酸与碳酸钠溶液反应产生的二氧化碳中含有水蒸气浓硫酸 碳酸钠的水溶液也呈碱性取少量白色固体放人烧杯中,加水搅拌使固体全部溶解,加入过量的BaCl2溶液,过滤,取少量滤液于试管中,滴加1~2滴酚酞溶液,若溶液不变红,说明白色固体中不含氢氧化钠 若溶液变红,说明白色固体中含氢氧化钠
【解析】(1)打开分液漏斗的活塞,考虑碳酸钠与稀盐酸反应,烧瓶中发生的现象是有大量气泡产生,为检验反应中是否有氧气生成,应将带火星的木条插入试管丙中,观察其是否复燃;
(2)由于BaCl2溶液与碳酸钠溶液反应,取少量溶液置于试管中,滴加少量BaCl2溶液,有白色沉淀产生,化学方程式为:Na2CO3+BaCl2=2NaCl+BaCO3↓;碳酸钠和氢氧化钠的溶液都呈碱性,另取少量溶液置于另一支试管中,滴加少量酚酞溶液,溶液变红色;
(3)稀硫酸与碳酸钠溶液反应产生的二氧化碳中含有水蒸气,水蒸气与过氧化钠反应生成氢氧化钠,所以玻璃管固体成分中含有氢氧化钠;所以应该在甲、乙装置之间增加图2装置,进行干燥,其中存放的试剂为浓硫酸;
(4)小组的其他同学对小燕的结论提出了质疑,认为溶液呈碱性不一定含有NaOH,理由是碳酸钠的水溶液也呈碱性,设计实验验证白色固体中是否含有氢氧化钠:取少量白色固体放入烧杯中,加水搅拌使固体全部溶解,加入过量的BaCl2溶液,过滤,取少量滤液于试管中,滴加1~2滴酚酞溶液,若溶液不变红,说明白色固体中不含氢氧化钠;若溶液变红,说明白色固体中含氢氧化钠。

 阅读快车系列答案
阅读快车系列答案