题目内容
A、B、C三种固体物质的溶解度曲线如图所示.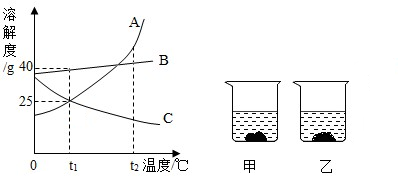
(1)t1℃时,A、B、C的溶解度大小关系是(用“>”、“<”或“=”表示)
(2)t2℃时,将A、B、C各25g分别放入100g水中,能形成饱和溶液的物质是
(3)t1℃时,将20gA物质充分溶解在50g水中所得溶液的溶质质量为
(4)当温度由t1℃升高至t2℃时(不考虑水分蒸发),乙烧杯中固体质量增加,则乙烧杯溶液中的溶质是
(5)若A溶液中含有少量C,提纯A晶体的结晶方法为

(1)t1℃时,A、B、C的溶解度大小关系是(用“>”、“<”或“=”表示)
B>A=C
B>A=C
,它们的等质量的饱和溶液中含水的质量最小的是B
B
(2)t2℃时,将A、B、C各25g分别放入100g水中,能形成饱和溶液的物质是
C
C
,而没有形成饱和溶液的,可将溶液温度降到t1℃时,又能恰好形成饱和溶液的是A
A
;(3)t1℃时,将20gA物质充分溶解在50g水中所得溶液的溶质质量为
12.5
12.5
克(4)当温度由t1℃升高至t2℃时(不考虑水分蒸发),乙烧杯中固体质量增加,则乙烧杯溶液中的溶质是
C
C
(填A或B或C)(5)若A溶液中含有少量C,提纯A晶体的结晶方法为
降温结晶
降温结晶
.分析:(1)根据某一温度时物质溶解度的比较方法考虑;等质量的饱和溶液中含水的质量最小的是溶解度最大的;(2)根据t1℃和t2℃时,A、B、C的溶解度考虑;(3)根据t1℃时,A物质的溶解度考虑;(4)温度由t1℃升高至t2℃时(不考虑水分蒸发),乙烧杯中固体质量增加,说明升温溶解度减小考虑;(5)根据固体物质从溶液中结晶析出的方法考虑.
解答:解:(1)从t1℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t1℃时它们的溶解度大小顺序是B>A=C;等质量的饱和溶液中含水的质量最小的是溶解度最大的所以B物质需要的水最少;
(2)由图示可知t2℃时,A、B的溶解度都大于25g,C的溶解度小于25g,所以t2℃时,将A、B、C各25g分别放入100g水中,能形成饱和溶液的物质是C;由图示可知t1℃时A物质的溶解度正好是25g,所以将溶液温度降到t1℃时,又能恰好形成饱和溶液的是A;
(3)t1℃时A物质溶解度是25g,即100g水中最多溶解25g,50g水中最多溶解12.5g,所以t1℃时,将20gA物质充分溶解在50g水中所得溶液的溶质质量为12.5g;
(4)温度由t1℃升高至t2℃时(不考虑水分蒸发),乙烧杯中固体质量增加,说明升温该物质的溶解度减小,由图示可知是C物质;
(5)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于A物质的溶解度随温度升高变化比较大,所以用降温结晶的方法提纯.
故答案为:(1)B>A=C;B;(2)C; A;(3)12.5;(4)C;(5)降温结晶.
(2)由图示可知t2℃时,A、B的溶解度都大于25g,C的溶解度小于25g,所以t2℃时,将A、B、C各25g分别放入100g水中,能形成饱和溶液的物质是C;由图示可知t1℃时A物质的溶解度正好是25g,所以将溶液温度降到t1℃时,又能恰好形成饱和溶液的是A;
(3)t1℃时A物质溶解度是25g,即100g水中最多溶解25g,50g水中最多溶解12.5g,所以t1℃时,将20gA物质充分溶解在50g水中所得溶液的溶质质量为12.5g;
(4)温度由t1℃升高至t2℃时(不考虑水分蒸发),乙烧杯中固体质量增加,说明升温该物质的溶解度减小,由图示可知是C物质;
(5)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于A物质的溶解度随温度升高变化比较大,所以用降温结晶的方法提纯.
故答案为:(1)B>A=C;B;(2)C; A;(3)12.5;(4)C;(5)降温结晶.
点评:溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.能灵活运用物质的溶解度解决一些实际问题.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目

(I)图(1)是 A、B、C三种固体物质的溶解度曲线.
请回答:
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是______;
(2)当温度从t2℃降到t1℃时,三物质的饱和溶液中没有晶体析出的是______.
(II)用图(2)中的装置可进行气体和固体的反应.
(1)请在下表中写出两组不同的反应物(两组气体必须各不相同).
| 组别 | 固 体 | 气 体 |
| 1 | ______ | ______ |
| 2 | ______ | ______ |

(I)图(1)是 A、B、C三种固体物质的溶解度曲线.
请回答:
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;
(2)当温度从t2℃降到t1℃时,三物质的饱和溶液中没有晶体析出的是 .
(II)用图(2)中的装置可进行气体和固体的反应.
(1)请在下表中写出两组不同的反应物(两组气体必须各不相同).
| 组别 | 固 体 | 气 体 |
| 1 | ||
| 2 |