题目内容
【题目】有一不纯的Na2CO3样品,杂质可能是K2CO3、CaCO3、FeCl3和NaCl中的一种或几种,取该样品10.6g,加入足量稀盐酸完全反应后得到无色溶液,同时产生4.4气体,下列判断正确的是( )
A. 杂质一定有FeCl3和CaCO3B. 杂质一定没有NaCl
C. 杂质可能是K2CO3、CaCO3、NaCl组成的D. 杂质可能是K2CO3和NaCl组成的
【答案】C
【解析】
碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钾和稀盐酸反应生成氯化钾、水和二氧化碳,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
A、加入足量稀盐酸完全反应后得到无色溶液,杂质一定没有FeCl3,故A不正确;
B、设生成4.4g的二氧化碳,需要碳酸钠的质量为x
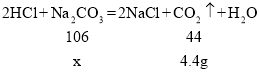
![]()
![]()
则原混合物中一定含有另一种碳酸盐,且碳酸盐产生二氧化碳的能力要与碳酸钠相对或比碳酸钠强,碳酸钠中碳酸根离子的质量分数为![]() ,碳酸钾中碳酸根离子的质量分数为
,碳酸钾中碳酸根离子的质量分数为![]() ,碳酸钙中碳酸根离子的质量分数为
,碳酸钙中碳酸根离子的质量分数为![]() ,则碳酸钾产生二氧化碳的能力比碳酸钠弱,碳酸钙产生二氧化碳的能力比碳酸钠强,则混合物中一定含有碳酸钠和碳酸钙,可能含有碳酸钾和氯化钠,故B不正确;
,则碳酸钾产生二氧化碳的能力比碳酸钠弱,碳酸钙产生二氧化碳的能力比碳酸钠强,则混合物中一定含有碳酸钠和碳酸钙,可能含有碳酸钾和氯化钠,故B不正确;
C、碳酸钾产生二氧化碳的能力比碳酸钠弱,碳酸钙产生二氧化碳的能力比碳酸钠强,则混合物中一定含有碳酸钠和碳酸钙,可能含有碳酸钾和氯化钠,故C正确;
D、碳酸钾产生二氧化碳的能力比碳酸钠弱,碳酸钙产生二氧化碳的能力比碳酸钠强,则混合物中一定含有碳酸钠和碳酸钙,可能含有碳酸钾和氯化钠,故D不正确。故选C。

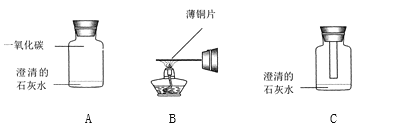
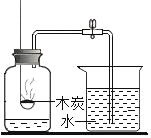
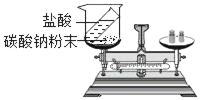
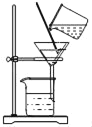
【题目】下列实验方案,能达到相应实验目的的是( )
A | B | C | D | |
实验方案 |
|
|
|
|
目的 | 测定空气中O2的含量 | 验证某气体燃烧生成CO2和H2O | 探究质量守恒定律 | 用H2O2溶液和MnO2制O2后回收MnO2 |
A. AB. BC. CD. D