题目内容
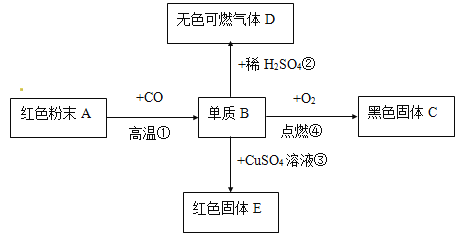
【题目】某化学兴趣小组在做“铁在氧气中燃烧”的实验时,进行了一系列探究活动,请你一同参与。
(探究一)铁丝燃烧是否需要纯氧
(实验内容)取长短相同,直径均为0. 38 mm的铁丝,分别在体积分数为90%,70%,60%,55%的O2中实验。
(实验现象)
氧气含量 | 90% | 70% | 60% | 55% |
实验现象 | 燃烧剧烈、燃烧 时间长,效果好 | 燃烧比90%弱, 燃烧时间短,实 验成功 | 燃烧比70%弱, 燃烧时间更短, 实验成功 | 难以燃烧,只是发红 |
(1)铁丝在氧气中燃烧的表达式为:_________________________________
(2)实验中所用的不同体积分数的氧气可用____________收集(填“向上排空气法”或“排水法”)。
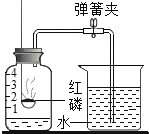
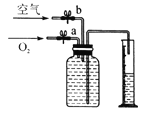
(3)若用如图装置收集一瓶(150 mL)含氧气的体积分数约为60%的气体,方法是在150 mL集气瓶里装满水,塞紧橡胶塞并关闭活塞b,打开活塞a通入氧气,把瓶里的水排入量筒,当量筒内的水达到设定的体积后立即关闭活塞a,然后打开活塞b通入空气,把瓶里的水全部排入量筒,则停止通入氧气时量筒内水的体积约为__________(提示:空气中氧气的体积分数约为![]() )。
)。
A25 mL B40 mL C60 mL D75 mL
(结论)就0. 38 mm铁丝而言,燃烧所需氧气的最低体积分数为___________,且氧气浓度越大,燃烧越_________(填“剧烈”或“不剧烈”)。
(拓展)小明指出上述关于铁丝燃烧所需氧气最低浓度的结论不合理,理由是_________________。
(探究二)铁丝燃烧产生火星四射的原因
(查阅资料)
①日常生活中的钢铁制品都含有少量碳杂质;
②含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象。
(实验内容)取长短相同、直径均为0. 20 mm、含碳量不同的铁丝分别在足量的氧气中燃烧,观察现象。
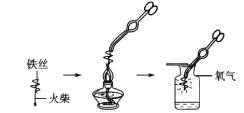
(1)小明按上图实验时,集气瓶中放水的目的是__________________。
(2)下表是他将几种铁丝放入氧气中燃烧时的实验现象的记录。请你分析完成下表:
物质 | 纯铁丝 | 含碳0.05 %的铁丝 | 含碳0.2 %的铁丝 | 含碳0.6 %的铁丝 |
燃烧时的现象 | 无火星四射现象,熔断 | 剧烈燃烧极少火星 | 剧烈燃烧少量火星 | __________________ |
(3)通过以上实验,说明铁丝燃烧产生火星四射现象和______________(填元素符号)有关
【答案】铁+氧气![]() 四氧化三铁 排水法 D 大于55% 剧烈 0.38mm的铁丝可能在氧气浓度为56%~59%的范围内燃烧 防止高温熔落物炸裂瓶底 剧烈的燃烧,火星四射 C
四氧化三铁 排水法 D 大于55% 剧烈 0.38mm的铁丝可能在氧气浓度为56%~59%的范围内燃烧 防止高温熔落物炸裂瓶底 剧烈的燃烧,火星四射 C
【解析】
(1)铁丝在氧气中燃烧生成四氧化三铁,文字表达式为:铁+氧气![]() 四氧化三铁;
四氧化三铁;
故填:铁+氧气![]() 四氧化三铁。
四氧化三铁。
(2)氧气不易溶于水,且要使用不同体积分数的氧气来进行实验。 故可用排水法收集不同体积氧气,所用的方法是:用集气瓶分别盛入不同体积的水,将这些瓶中的水恰好排尽,即为收集到的各体积的氧气了。
故填:排水法。
(3)这一瓶气体中氧气的总量为150mL×60%=90mL,氮气的体积是:150mL-90mL=60mL;空气的体积是:60mL÷![]() =75mL,那么停止通入氧气时量筒内水的体积约为:150mL-75mL=75mL;
=75mL,那么停止通入氧气时量筒内水的体积约为:150mL-75mL=75mL;
故选D。
[结论]由于0.38mm的铁丝在60%的氧气中还能够燃烧,在55%时已经不能燃烧的事实可知:燃烧所需氧气的最低体积分数为大于55%,且氧气浓度越大,燃烧越剧烈;
故填:大于55%;剧烈。
[拓展]由于0.38mm的铁丝在60%的氧气中还能够燃烧,在55%时已经不能燃烧的事实可知:燃烧所需氧气的最低体积分数为大于55%,故这种铁丝有可能在氧气浓度为56%~59%的范围内燃烧,所以上述关于铁丝燃烧所需氧气最低浓度的结论是不合理;
故填:0.38mm的铁丝可能在氧气浓度为56%~59%的范围内燃烧。
[实验内容]
(1)小明按上图实验时,集气瓶中放水的目的是防止高温熔落物炸裂瓶底。
故填:防止高温熔落物炸裂瓶底。
(2)由实验现象可知,随着铁丝中含碳量的升高,铁丝燃烧越来越剧烈,火星越来越多,含碳0.6%的铁丝能够在氧气中剧烈的燃烧,火星四射;
故填:剧烈的燃烧,火星四射。
(3)通过以上实验,说明铁丝燃烧产生火星四射现象和碳元素的含量有关,碳元素的元素符号是C。故填:C。

 阅读快车系列答案
阅读快车系列答案【题目】以下是某研究小组探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃;“浓度”指溶质的质量分数)
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/mL | 反应所需时间/s |
① | 5 | 12 | 20 | 0.2 | 125 | 11 |
② | 30 | 12 | 20 | 0.2 | 125 | 2 |
③ | 30 | 12 | 40 | / | 125 | 148 |
④ | 30 | 12 | 90 | / | 125 | 82 |
(1)写出实验室用过氧化氢制氧气的文字表达式____________。
(2)通过实验①和②对比可知,化学反应快慢与______有关。
(3)通过对比实验______和______可知,化学反应快慢与温度的关系是______。
(4)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是______。