题目内容
【题目】(2017唐山古冶区一模)某化学课堂围绕“酸碱中和反应”,在老师引导下开展探究活动。以下是教学片段。请你参与学习并帮助填写空格(包括表中空格)。
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。
该反应的化学方程式为_______。
(提出问题)实验中未观察到明显现象,部分同学产生了疑问;反应后溶液中溶质是什么呢?
(假设猜想)针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4;
猜想二:有Na2SO4和H2SO4;
猜想三:有Na2SO4、H2SO4和NaOH;
猜想四:有______。
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的,不合理的是猜想____。
(实验探究)(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有___。
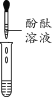
(2)为了验证其余猜想,该学习小组利用烧杯中的溶液,并选用老师提供的酚酞溶液、铁片、Na2CO3溶液,进行如下三个方案的探究。
实验方案 | ①加入酚 酞溶液 | ②加入铁片 | ③滴加Na2 CO3溶液 |
实验 操作 |
|
|
|
实验现象 | 溶液不变色 | ____ | 产生气泡 |
实验结论 | 溶液中有 H2SO4 | 溶液中有 H2SO4 | 溶液中有 H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
(评价反思)(1)老师对同学们能用多种方法进行探究给予肯定,同时指出实验方案①不能得出正确结论,原因是_____。
(2)请你再选择一种与以上三种试剂属不同类别的试剂进行验证,写出实验步骤和现象________。
【答案】H2SO4 + 2NaOH=Na2SO4 + 2H2O NaOH和Na2SO4 三 NaOH 产生气泡 中性和酸性溶液都不能使酚酞溶液变色,方案①中加入酚酞溶液后,溶液不变色,说明溶液呈中性或酸性,不一定含有H2SO4 选择氧化铜或氢氧化铜。将少量氧化铜或氢氧化铜固体加入到反应后的溶液中,可观察到固体全部溶解,溶液由无色变为蓝色
【解析】
【演示实验】稀硫酸和氢氧化钠反应的化学方程式为H2SO4+2NaOH=== Na2SO4+2H2O。【假设猜想】对于酸碱反应后溶液中的溶质有三种情况:①恰好中和,溶质为Na2SO4;②酸过量,溶质为H2SO4和Na2SO4;③碱过量,溶质为NaOH 和Na2SO4。 猜想三中H2SO4和NaOH不能共存,属于不合理的猜想。【实验探究】(1)硫酸铜溶液和氢氧化钠溶液反应会产生Cu(OH)2蓝色沉淀,滴加几滴硫酸铜溶液,无明显变化,说明溶液中一定没有NaOH。(2)铁和稀硫酸反应生成硫酸亚铁和氢气,故将铁片加入到反应后的溶液中,由实验论知溶液中有硫酸,则可观察到有气泡产生。【评价反思】(1)方案①中加入酚酞溶液后,溶液不变色,说明溶液呈中性或酸性,不一定有H2SO4。(2)题中已出现酸和指示剂、金属、盐的反应,还剩酸与金属氧化物、碱的反应,所以可选择氧化铜或氢氧化铜,若溶液中有H2SO4,可观察到的现象是固体全部溶解,溶液由无色变为蓝色。

【题目】下表是NaCl、KNO3在不同温度时的溶解度:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解 度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
据此数据判断,下列说法不正确的是( )
A.NaCl和KNO3的溶解度曲线在20 ℃~30 ℃范围内会相交
B.在40 ℃时,100 g NaCl饱和溶液中的溶剂质量大于100 g KNO3饱和溶液中的溶剂质量
C.在50 ℃时,NaCl和KNO3各30 g分别加入两只各盛有50 g水的烧杯中,均不能形成饱和溶液
D.在60 ℃时,向52.5 g KNO3饱和溶液中加入47.5 g水,溶液中溶质的质量分数为27.5%
【题目】(2017邯郸二模)某兴趣小组为探究“酒精燃烧的产物”,进行了一系列实验活动,请回答相关问题。
(作出猜想)酒精燃烧的产物有CO2和H2O。
(进行实验)
点燃放置一段时间的酒精灯 | |
实验1 | 将干冷烧杯罩在火焰上方,观察到___,证明有H2O生成 |
实验2 | 用内壁涂有饱和石灰水的小烧杯罩在火焰上方,观察到石灰水___,证明有CO2生成。此反应的化学方程式为_____ |
(反思交流)
(1)甲同学认真分析实验1,认为生成的水可能是由于____,于是做了如下改进实验:点燃刚加入纯酒精的酒精灯,将干冷烧杯罩在酒精灯火焰上方,观察到与实验1相同的现象,证明酒精燃烧有H2O生成。
![]()
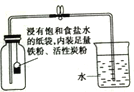
(2)乙同学针对实验2提出质疑:石灰水变浑浊不一定是生成碳酸钙,还可能是饱和石灰水受热后__,析出了氢氧化钙固体。于是乙同学做了如图改进实验:6秒后,将锥形瓶加塞子正放在桌面上,待温度恢复至原温时,注入20 mL饱和石灰水振荡,观察到石灰水变浑浊 ,确定有CO2生成。
(3)丙同学观察到棉线灯芯有部分烧黑。由此认为(2)中乙同学的改进实验产生的CO2可能由灯芯棉线燃烧产生的。随后丙同学又做了对比实验:将如图的酒精灯换为盛有纯酒精的____(选填字母:A 量筒 B 集气瓶 C 蒸发皿)后直接点燃,进行实验,仍观察到澄清石灰水变浑浊。证明酒精燃烧有CO2生成。
(得出结论)酒精燃烧的产物有CO2和H2O。
(拓展应用)在验证产物的实验中,应该____(填序号)。
①利用对比法尽量排除其他因素的干扰
②有科学严谨的态度
③注意实验器材的选择
④不考虑那么多的因素,大致看到现象即可
【题目】经过监测和治理,我省的土壤质量已经得到了很好的改善,但个别地区仍然存在盐碱地。某校化学兴趣小组的同学们为此开展了实践活动,他们采集了本地的土样,并对土样围绕两个问题进行探究。
查阅资料
①枸杞和合欢均可在轻度盐碱地中生存。
②盐碱地显碱性。
③该土样中的可溶性物质只含NaCl,CaCl2和Na2CO3。
探究过程
(1)甲组探究土样的酸碱度
具体操作是 ,由此得出,该土样的pH>7。
(2)乙组探究土样的成分(如图所示)
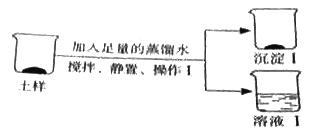
向土样中加入足量的蒸馏水,发生反应的化学方程式 。
同学们对溶液I中的溶质成分很感兴趣,作出如下猜想:
猜想一:只含NaCl
猜想二:含NaCl、CaCl2
猜想三:含NaCl、Na2CO3
设计实验,继续探究:
验证猜想所用试剂 | 实验现象 | 实验结果 | |
方案一 | AgNO3溶液和稀硝酸 | 有白色沉淀生成 | 猜想①正确 |
方案二 | 无明显现象 | 猜想②不正确 | |
方案三 | 猜想③正确 |
反思与评价:
①通过交流,甲组认为乙组的方案一不太严谨,理由是 。
②同学们对沉淀 CaCO3的来源展开了热烈的讨论。一致认为 CaCO3也可能来自土样本身。请解释土样中存在 CaCO3的原因 。
总结与提升:
改良我省的盐碱地,充分利用土地资源,造福山西人民,我们任重而道远。以下建议你认为正确的是
A.轻度盐碱地可以种植枸杞
B.可以用熟石灰改良盐碱地
C.盐碱地应避免施用碱性化肥