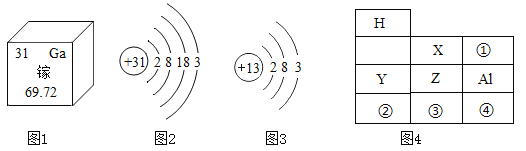
题目内容
【题目】根据下图回答问题。
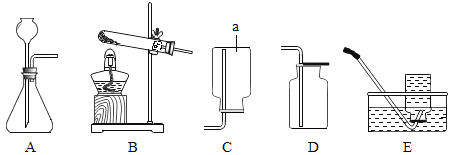
(1)仪器a的名称为_________。
(2)氨气是一种无色气体,密度比空气小,极易溶于水,有刺激性气味,污染环境。加热氯化铵和熟石灰的固体混合物可制取氨气,实验室制取并收集氨气,所选择的发生装置和收集装置分别是_________和_________。
(3)实验室用制取二氧化碳选用的发生装置是_____(填字母序号);反应的化学方程式为________。
(4)下图是木炭在氧气中燃烧的实验示意图。如何证明木炭与氧气发生了化学反应(化学方程式)_________。
(5)实验室称取10g铜锌合金放入烧杯中,向其中加入100g一定质量分数的稀盐酸,恰好完全反应,反应后的烧杯中剩余物的总质量为109.8g,求铜锌合金中铜的质量分数________。
【答案】集气瓶 B C A ![]()
![]() 35%。
35%。
【解析】
(1)仪器a的名称为:集气瓶。
(2)加热氯化铵和熟石灰的固体混合物可制取氨气,实验室制取并收集氨气,所选择固体加热装置B,氨气是一种无色气体,密度比空气小,极易溶于水,有刺激性气味,污染环境,用向下排空气法收集氨气,选择装置C;
(3)实验室用石灰石与稀盐酸反应制取二氧化碳(不需要加热)选用固液发生装置是A;石灰石与稀盐酸反应产氯化钙、水和二氧化碳气体的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)木炭在氧气中燃烧产生二氧化碳气体,将气体通入澄清的石灰水中,石灰水变浑浊,二氧化碳与氢氧化钙反应产生碳酸钙沉淀和水的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O。
(5)解:由质量守恒定律可知:产生氢气质量=100g+10g-109.8g=0.2g。
设:合金中锌的质量为x。
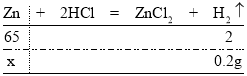
![]() x=6.5g
x=6.5g
合金中铜的质量分数=![]() 。
。

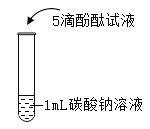
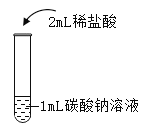
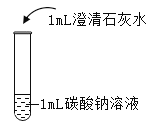
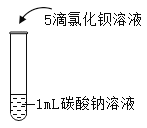
【题目】在课堂中通过实验探究了碳酸钠的性质,请回答下列问题。
实验一 | 实验二 | 实验三 | 实验四 | |
实验操作 |
|
|
|
|
实验现象 | 液体呈现红色 | 产生气泡 | _______ | ___________ |
实验结论 | ________ | _______ | 碳酸钠能与氢氧化钙反应。 | 碳酸钠能与氯化钡反应。 |