题目内容
【题目】某课外活动小组进行如下实验探究。

(1)验证物质的燃烧条件根据图1进行实验,实验现象如图所示。
①80℃热水的作用是_____。
②比较现象a、c,得出燃烧的条件是_____。
(2)验证锌与铁的金属活动性
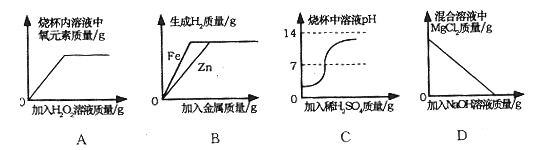
①相同条件下,取等质量锌粉、铁粉,根据图2进行实验,实验过程中,观察到锌粉表面产生气泡的速率比铁粉快,由此得到的结论是_____。
②实验结束后,发现∪形管两边的金属粉末均无剩余,则硫酸剩余的情况可能是_____(填序号)。
A.左、右两边均有剩余 B.左边有剩余,右边无剩余
C.左、右两边均无剩余 D.左边无剩余,右边有剩余
(3)测定水中氢氧元素的质量比(已知H2+CuO△Cu+H2O)
根据图3进行实验,反应后测得甲中玻璃管(含药品)质量减少ag,乙中U形管(含药品)质量增加bg。
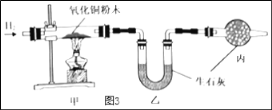
①水中氢、氧元素的质量比是_____(用含 a、b的式子表示)。
②下列因素中,对测定结果有影响的是_____(填序号)。
A.CuO粉末不干燥 B.CuO没有完全转化为Cu C.没有丙装置
【答案】 一是热源,二是隔绝氧气或者空气。 燃烧需要达到一定的温度(着火点)。 锌比铁活泼。 AB。 (b﹣a):a。 AC。
【解析】(1)①图1中80℃热水的作用是一是为铜片上的白磷提供热量,使温度达到白磷的着火点;二是对水中的白磷起隔绝氧气的作用;
②白磷和红磷都是可燃物,铜片上的白磷和红磷都与氧气接触,唯一不同点是白磷的着火点比红磷的着火点低,故温度达到了白磷的着火点,没有达到红磷的着火点,故铜片上的白磷燃烧而红磷没有燃烧,故可以说明燃烧的条件是燃烧需要达到一定的温度(着火点)。
(2)①锌粉和铁粉与相同质量分数、相同体积的稀硫酸反应,锌粉冒出的气泡较剧烈,说明锌与稀硫酸反应较快,故说明锌比铁活泼;②等质量锌粉、铁粉加入等质量分数等体积的稀硫酸中,两种金属完全反应,等质量锌粉、铁粉与稀硫酸反应需要稀硫酸的质量锌比铁少,故与锌反应的稀硫酸一定有剩余,与铁反应的稀硫酸可能有剩余,可能恰好完全反应,故可能情况为两边都有剩余,或左边有剩余,右边无剩余,故选AB;
(3)①氢气与氧化铜反应生成铜和水,由质量守恒定律可知,反应物中减少的质量是氧化铜中氧元素的质量,转化到了水中,故生成bg的水中氧元素的质量为ag ,故水中氢元素的质量为(b - a)g,故水中氢、氧元素的质量比为(b - a):a;②A、如果氧化铜粉末有水分,则乙装置中增加水的质量比实际生成水的质量大,即b的值偏大,故比值偏大;B、参加反应的氧化铜中的氧元素全部转化给了水,并且反应物中固体的质量减少的量就是氧元素的质量,故测定过程中氧化铜是否完全反应不影响实验结果;C、如果没有丙装置,空气中的水分有可能进入乙装置中,使测量水的质量比实际生成水的质量偏大,故测量结果不准确;故选AC。

【题目】氢氧化钙和氢氧化钠是两种常见的碱。小花同学将两种碱溶液分别装入试管A、B两支试管中,并进行如下图所示的三组实验。

(1)实验1中,两支试管的溶液都变成________色。
(2)实验2中,若试管B中盛装的是NaOH溶液,发生反应的化学方程式为___________________________,该反应的基本类型是_______反应。
(3)实验3中,某同学向两支试管中吹气,A中有白色沉淀产生,发生反应的化学方程式为______________________________。B中无明显现象,为了探究吹气后B中溶质的成分,该同学进行了如下探究。
(提出猜想)猜想1:溶质是氢氧化钠;
猜想2:溶质是碳酸钠;
猜想3:溶质是_____________。
溶质中出现碳酸钠的原因是氢氧化钠与__________发生了反应。
(实验和结论)
实验 | 实验现象 | 结论 |
取B中少量溶液,加入澄清石灰水至不再产生沉淀为止,静置后取上层清液,向其中滴加几滴酚酞溶液 | ____________ | 猜想3成立 |
(反思与评价)
老师评价该同学得出的结论不正确,是因为猜想2也会产生相同的现象。如果要验证“猜想3成立”,必须要将氢氧化钙溶液换成_________溶液。