题目内容
【题目】贝壳的主要成分是碳酸钙。为了测定某贝壳中碳酸钙的质量分数,小林同学进行了如下实验:将贝壳洗净、干燥并捣碎后,称取12 g 放在烧杯里,然后往烧杯中加入足量的稀盐酸45 g,充分反应后,称得反应剩余物为52.6 g。(假设其他物质不与盐酸反应)
(1)产生二氧化碳气体________g。
(2)计算该贝壳中碳酸钙的质量分数______。
【答案】4.4 83.3%
【解析】
(1)根据质量守恒定律可得,生成的二氧化碳的质量为12g+45g﹣52.6g=4.4g;
(2)设:贝壳中碳酸钙的质量为x
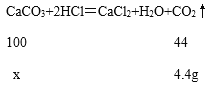
![]() x=10g;
x=10g;
该贝壳中碳酸钙的质量分数=![]()
答:(1)产生二氧化碳气体 4.4g。
(2)该贝壳中碳酸钙的质量分数为83.3%。

【题目】生命的孕育和维系需要水,科学研究离不开水.请你完成下列探究。
(1)探究一:用水作溶剂.在盛有5mL水和5mL汽油的两只试管中分别加入1~2小粒高锰酸钾,可观察到的现象是______,结论:同一种物质在不同溶剂中的溶解性不同。该实验量取5ml液体需要用到的仪器是_______和________
(2)探究二:用水区别物质.自选两种白色固体,用水区别它们,设计实验完成下表内容。
两种白色固体 | 主要操作、现象和结论 |
_______ | ____ |
(3)探究三:溶质在水中的溶解与结晶。
(查阅资料)熟石灰与碳酸氢铵、氯化铵混合研磨,生成有刺激性气味的气体;碳酸氢铵、碳酸氢钠与稀盐酸反应生成无色无味的气体;20℃时,五种物质的溶解度如下表。
物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 | Na2CO3 |
溶解度/g | 36.0 | 21.0 | 37.2 | 9.6 | 21.5 |
相同温度下,不同溶质同时溶解在同一溶剂中,溶解度不变。
(提出问题)20℃时,将11.7gNaCl和15.8gNH4HCO3同时放入盛有100g水的烧杯中,充分搅拌,静置,有晶体析出(温度仍为20℃)。析出的晶体是什么?
(设计实验)设计方案,并进行实验。
①取少量晶体与熟石灰粉末混合、研磨,无明显现象,说明该晶体不可能是_______。
②取少量晶体于试管中,加入_______,现象为生成无色无味的气体。
③(实验结论)析出的晶体是_______。
④(实验拓展)析出晶体的原因是_______。
【题目】如图是元素周期表中的一部分,请回答下列问题:
第一周期 |
|
| ||||||
第二周期 |
|
|
| ① |
|
|
|
|
第三周期 |
|
|
|
|
|
| ② |
|
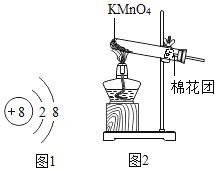
(1)上表中①所示元素的原子结构示意图是______,②所示元素的元素名称是______。
(2)![]() 与
与![]() 的核外电子排布相同,则X的元素符号是______,它处在元素周期表中第______周期。
的核外电子排布相同,则X的元素符号是______,它处在元素周期表中第______周期。
(3)写出一条上表中第二周期原子核外电子排布的规律__________________。
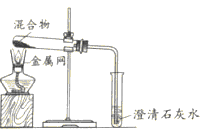
【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体。②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,
(进行实验)
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1—1 | 1—2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1—2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2—1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2—2 | 1:10 | 混有很少量黑色物质 | |
2—3 | 1:11 | 混有极少量黑色物质 | |
2—4 | 1:12 | 无黑色物质 | |
2—5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)配平化学方程式:□C+□CuO高温 □Cu+ □CO2↑______,这个反应中CuO是______剂。
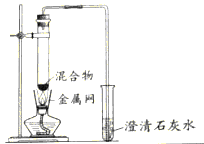
(2)实验1—2中,证明此产生了CO2的现象是__________,写出化学方程式______________
(3)实验1的目的是___________。
(4)实验2的结论是:木炭与氧化铜反应的最佳质量比为_______。