题目内容
【题目】NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示 (注:![]() 表示氮原子,
表示氮原子,![]() 表示氧原子,
表示氧原子,![]() 表示氢原子;各物质未配平)。请写出该反应的化学反应的方程式______________________________;写出其中属于氧化物的化学式____________________。
表示氢原子;各物质未配平)。请写出该反应的化学反应的方程式______________________________;写出其中属于氧化物的化学式____________________。
![]()
【答案】4NH3+5O2 4NO+6H2O NO、H2O
4NO+6H2O NO、H2O
【解析】
由微粒的构成分析可知,一定条件下,氨气和氧气反应能生成一氧化氮和水,反应的化学方程式为:4NH3+5O2 4NO+6H2O.氧化物是两种元素组成且其中一种是氧元素的纯净物,观察该反应的物质情况可知氧化物为:NO、H2O。
4NO+6H2O.氧化物是两种元素组成且其中一种是氧元素的纯净物,观察该反应的物质情况可知氧化物为:NO、H2O。
故答案为:4NH3+5O2 4NO+6H2O;NO、H2O。
4NO+6H2O;NO、H2O。

【题目】化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl。某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
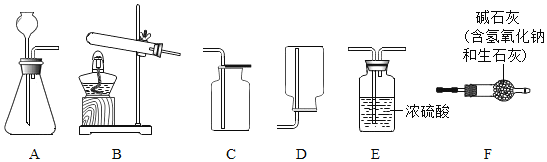
I.气体制备
(1)二氧化碳气体制备实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为____________________________.应选择的气体收集装置为____________________________(选填装置对应的字母).实验室不用稀硫酸与石灰石制取二氧化碳的原因是__________________________________________。
(2)氨气制备
实验室常用氢氧化钙固体与氯化铵固体加热制备NH3反应方程式:______________________________________________;现要制备并收集干燥的NH3,所选装置的正确连接顺序为 B→______________________ →_______________________ (选择装置对应的字母).实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式_____________________________________________________.
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因 ______________________________.
(4)该过程中另一产物NH4Cl在农业生产中常被用作_______________.
【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
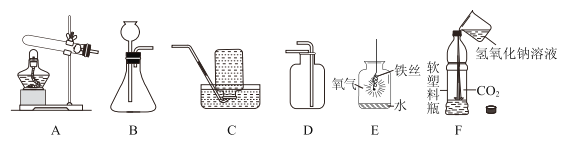
A氧气的制备与性质 | B二氧化碳的制备与性质 |
(1)实验室用高锰酸钾制取氧气,反应的化学方程式为__________。 (2)E中的反应的方程式为_____。 | (1)实验室制取二氧化碳,反应的化学方程式为______。 (2)F中旋紧瓶盖后振荡,瓶中发生反应的化学方程式为______。 |
【题目】结合下列过程,回答有关问题。
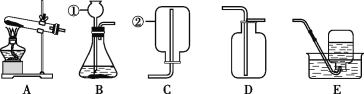
(1)写出标号仪器的名称:①____,②____。
(2)实验室制取并收集二氧化碳的装置组合为____,化学方程式为____。
(3)写出实验室用高锰酸钾制取O2的化学方程式:______。试管口放一团棉花的目的是____,用E装置收集满时,接下来的操作顺序是____(填序号)。
①用玻璃片盖住集气瓶 ②将集气瓶正放在桌面 ③熄灭酒精灯 ④移出导管
(4)向5mL 5%的H2O2溶液中加入2滴一定浓度的FeCl3溶液,立即产生大量气泡。已知FeCl3溶液中主要含有三种微粒:H2O、Fe3+、Cl-。
[问题] 哪种微粒对H2O2溶液的分解起催化作用?
[假设] 假设一:可能是H2O;假设二:可能是Fe3+;假设三:可能是Cl-。
[分析] 假设一不可能成立,理由是______。
[实验]
操作 | 现象 | 结论 |
其他条件不变,向H2O2溶液中加入NaCl溶液 | 无明显变化 | 假设____成立 |
其他条件不变,向H2O2溶液中加入Na2SO4溶液 | 无明显变化 | |
其他条件不变,向H2O2溶液中加入Fe2(SO4)3溶液 | 立即产生大量气泡 |
(5)从循环利用的角度分析,二氧化锰与氯化铁溶液相比,____(填化学式)更适合作该反应的催化剂。