题目内容
化学与我们的生产、生活有着非常密切的联系,利用家庭生活中常见的物品也能进行很多化学探究活动.下面是小华利用家中相关物品进行的实验探究:
(1)小华将石蕊溶液分别滴入白醋和纯碱溶液中,发现石蕊在白醋中变红色,在纯碱溶液中变蓝色,说明白醋显酸性,纯碱溶液的pH 7(填“大于”、“小于”或“等于”).
(2)白醋的主要成分是醋酸,酸有很多相似的性质,如:
①酸能使石蕊变红
②酸能与活泼金属反应生成盐和氢气
③酸能与碱反应生成盐和水
④酸能与金属氧化物反应生成盐和水
⑤酸能与碳酸盐反应生成盐、水和二氧化碳等.
为什么不同的酸都具有相似化学性质?小华将生锈的铁钉放在小玻璃杯中,加入白醋,发现 ,说明白醋能与铁锈反应.小华想到目前世界卫生组织正在推广使用中国铁锅,于是建议在使用铁锅做菜时放点醋,可以补充人体需要的微量元素铁元素,原因是 (填序号);同时由于 (填序号),他还认为可以用白醋来除去水壶中的水垢.小华将白醋滴加到纯碱溶液中,发现溶液中有气泡产生,他认为酸碱发生中和反应时,生成了气态的水,请问:小华的认识正确吗?为什么?
(3)小华发现某食品包装中装有一小袋“生石灰干燥剂”,主要成分是氧化钙,他将此干燥剂放入水中,发现水的温度升高了,这是因为 .
(4)小华经查阅材料得知,醋酸的化学式为CH3COOH,则醋酸中碳元素的质量分数为 .
(5)鸡蛋壳的主要成分是碳酸钙,小华将12.5g鸡蛋壳放入100g足量的食醋中,充分反应后剩余物质的质量为108.1g,请计算该鸡蛋壳中含有碳酸钙的质量分数是多少?[提示:2CH3COOH+CaCO3═Ca(CH3COO)2+H2O+CO2↑].
(1)小华将石蕊溶液分别滴入白醋和纯碱溶液中,发现石蕊在白醋中变红色,在纯碱溶液中变蓝色,说明白醋显酸性,纯碱溶液的pH
(2)白醋的主要成分是醋酸,酸有很多相似的性质,如:
①酸能使石蕊变红
②酸能与活泼金属反应生成盐和氢气
③酸能与碱反应生成盐和水
④酸能与金属氧化物反应生成盐和水
⑤酸能与碳酸盐反应生成盐、水和二氧化碳等.
为什么不同的酸都具有相似化学性质?小华将生锈的铁钉放在小玻璃杯中,加入白醋,发现
(3)小华发现某食品包装中装有一小袋“生石灰干燥剂”,主要成分是氧化钙,他将此干燥剂放入水中,发现水的温度升高了,这是因为
(4)小华经查阅材料得知,醋酸的化学式为CH3COOH,则醋酸中碳元素的质量分数为
(5)鸡蛋壳的主要成分是碳酸钙,小华将12.5g鸡蛋壳放入100g足量的食醋中,充分反应后剩余物质的质量为108.1g,请计算该鸡蛋壳中含有碳酸钙的质量分数是多少?[提示:2CH3COOH+CaCO3═Ca(CH3COO)2+H2O+CO2↑].
分析:(1)根据石蕊在纯碱溶液中变蓝色,说明纯碱的溶液显碱性进行解答;
(2)根据酸的化学性质进行解答;
(3)根据氧化钙和水反应生成氢氧化钙的过程中放热进行解答;
(4)根据化合物中某元素的质量分数=
×100%进行解答;
(5)根据醋酸和碳酸钙可以生成气体二氧化碳,所以反应后质量的减小值即为二氧化碳的质量,利用二氧化碳的质量结合该反应的方程式即可解决其它问题.
(2)根据酸的化学性质进行解答;
(3)根据氧化钙和水反应生成氢氧化钙的过程中放热进行解答;
(4)根据化合物中某元素的质量分数=
| 相对原子质量×原子个数 |
| 相对分子质量 |
(5)根据醋酸和碳酸钙可以生成气体二氧化碳,所以反应后质量的减小值即为二氧化碳的质量,利用二氧化碳的质量结合该反应的方程式即可解决其它问题.
解答:解:(1)石蕊在纯碱溶液中变蓝色,说明纯碱的溶液显碱性,所以纯碱溶液的pH大于7;故填:大于;
(2)酸在水溶液中都能解离出共同的离子H+,所以不同的酸都具有相似化学性质;将生锈的铁钉放在小玻璃杯中,加入白醋,发现铁锈溶解,溶液逐渐变黄色,说明白醋能与铁锈反应;在使用铁锅做菜时放点醋,可以补充人体需要的微量元素铁元素,原因是金属可以和酸反应;因为酸可以和碳酸盐反应生成盐、水和二氧化碳,所以可用白醋来除去水壶中的水垢;将白醋滴加到纯碱溶液中,发现溶液中有气泡产生,原因是:纯碱不是碱,是碳酸钠,气泡是碳酸钠与酸反应生成的二氧化碳;故填:酸在水溶液中都能解离出共同的离子H+;铁锈溶解,溶液逐渐变黄色;②;⑤;不正确;纯碱不是碱,是碳酸钠,气泡是碳酸钠与酸反应生成的二氧化碳;
(3)氧化钙和水反应生成氢氧化钙的过程中放热,所以氧化钙放入水中,水的温度升高了;故填:氧化钙与水反应时放出大量热;
(4)醋酸中碳元素的质量分数为
×100%=40%;故填:40%;
(5)设鸡蛋壳中含有碳酸钙的质量为x
生成二氧化碳的质量=12.5g+100g-108.1g=4.4g
2CH3COOH+CaCO3=Ca(CH3COO)2+H2O+CO2↑
100 44
x 4.4g
=
解得:x=10g
鸡蛋壳中含有碳酸钙的质量分数为
×100%=80%
答:鸡蛋壳中含有碳酸钙的质量分数为80%.
(2)酸在水溶液中都能解离出共同的离子H+,所以不同的酸都具有相似化学性质;将生锈的铁钉放在小玻璃杯中,加入白醋,发现铁锈溶解,溶液逐渐变黄色,说明白醋能与铁锈反应;在使用铁锅做菜时放点醋,可以补充人体需要的微量元素铁元素,原因是金属可以和酸反应;因为酸可以和碳酸盐反应生成盐、水和二氧化碳,所以可用白醋来除去水壶中的水垢;将白醋滴加到纯碱溶液中,发现溶液中有气泡产生,原因是:纯碱不是碱,是碳酸钠,气泡是碳酸钠与酸反应生成的二氧化碳;故填:酸在水溶液中都能解离出共同的离子H+;铁锈溶解,溶液逐渐变黄色;②;⑤;不正确;纯碱不是碱,是碳酸钠,气泡是碳酸钠与酸反应生成的二氧化碳;
(3)氧化钙和水反应生成氢氧化钙的过程中放热,所以氧化钙放入水中,水的温度升高了;故填:氧化钙与水反应时放出大量热;
(4)醋酸中碳元素的质量分数为
| 12×2 |
| 12×2+1×4+16×2 |
(5)设鸡蛋壳中含有碳酸钙的质量为x
生成二氧化碳的质量=12.5g+100g-108.1g=4.4g
2CH3COOH+CaCO3=Ca(CH3COO)2+H2O+CO2↑
100 44
x 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
解得:x=10g
鸡蛋壳中含有碳酸钙的质量分数为
| 10g |
| 12.5g |
答:鸡蛋壳中含有碳酸钙的质量分数为80%.
点评:本题考查了酸、碱的化学性质,完成此题,可以依据酸的性质进行,所以要求同学们需要识记常见物质间的反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
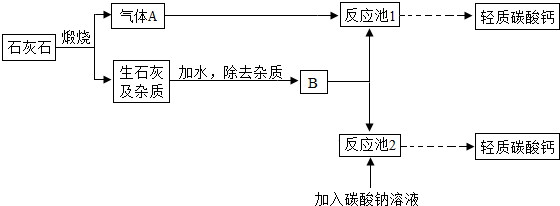
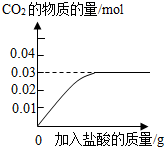

 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O

 Ca(HCO3)2;Ca(HCO3)2
Ca(HCO3)2;Ca(HCO3)2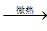
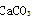 ↓+CO2↑+H2O
↓+CO2↑+H2O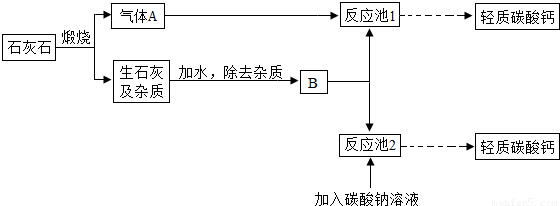
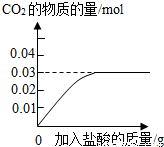
 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O

 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O