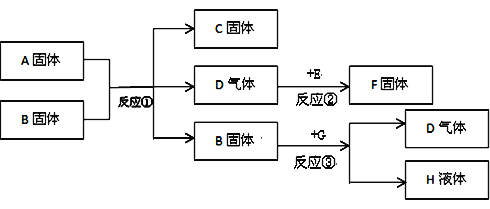
题目内容
【题目】已知30℃时,Na2SO3在水中的溶解度为36g。在一定量Na2SO3的溶液中加入6.4g Na2SO3后,恰好为30℃的饱和溶液。若用Na2SO37H2O晶体代替Na2SO3,欲使原溶液在30℃时恰好为饱和溶液,则需加入的Na2SO37H2O的质量为( )
A. 12.8g B. 14.6g C. 20g D. 25g
【答案】C
【解析】
设:6.4g Na2SO3溶解在质量为x水中达到饱和,由溶解度的意义可得:![]() ,
, ![]() 。设:加入的Na2SO37H2O的质量为y,由化学式Na2SO37H2O可知,Na2SO37H2O中Na2SO3与H2O的质量比=126:7×18=1:1,所以Na2SO3的质量为0.5y,含有的结晶水的质量为0.5y,由溶解度的意义可得:
。设:加入的Na2SO37H2O的质量为y,由化学式Na2SO37H2O可知,Na2SO37H2O中Na2SO3与H2O的质量比=126:7×18=1:1,所以Na2SO3的质量为0.5y,含有的结晶水的质量为0.5y,由溶解度的意义可得:![]() 解得:y=20g。故选C。
解得:y=20g。故选C。

【题目】水和二氧化碳而变质。某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程。
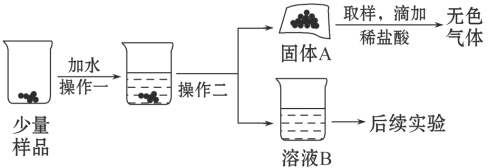
请你参与探究过程:
(1)为了使样品充分溶解,操作一还要用到的玻璃仪器是 ;操作二的名称是 。
(2)固体A中一定含有 。
(3)溶液B成分的探究:
【查阅资料】①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性。
【猜想】溶液B中的溶质可能为:①NaOH ②Na2CO3
③NaOH和Na2CO3 ④Ca(OH)2和 (填化学式)。
【设计方案并进行实验】甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3。
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH。
【反思与评价】丙同学认真分析上述两位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断。他认为溶液B中的溶质一定含有Na2CO3,可能含有NaOH。为进一步确认溶液B中是否含NaOH,他做了如下实验。
实验步骤 | 实验现象 | 实验结论 |
①取少量溶液B于试管中,加入足量CaCl2溶液 ②过滤,在滤液中滴加酚酞试液 | ①有白色沉淀生成 ②溶液由无色变为红色 | 猜想③正确 |
实验步骤①中发生的化学反应方程式是 ,其实验目的是 。
(4)实验过程中,同学们发现向样品中加水时还放出大量的热,综合以上探究,下列对样品成分分析正确的是 (填序号)。
A.一定有NaOH
B.一定有Na2CO3
C.一定有CaO
D.至少有NaOH、CaO中的一种