题目内容
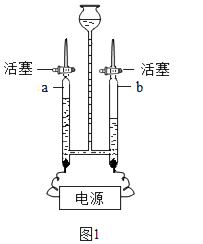
【题目】海洋是巨大的资源宝库、国防金属﹣﹣镁,就是利用海水制取的.工业上从海水中提取单质镁的过程如图1所示: 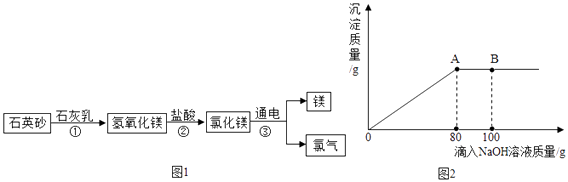
(1)在上述转化过程中发生中和反应的步骤是(填序号).
(2)海水中本身就含有氯化镁,请分析①、②两步再得到氯化镁的目的是 .
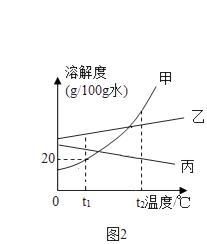
(3)小明同学在实验室中用NaOH溶液替代石灰乳模拟生产过程中的第①步,他取NaCl和MgCl2的固体混合物25g,加入适量水完全溶解后,与溶质质量分数为20%的NaOH溶液混合充分反应,记录生成的沉淀与加入NaOH溶液质量关系如图2所示: ①当滴入上述NaOH溶液至图中B点时,烧杯中溶液里含有的溶质为(写化学式).
②当滴入上述NaOH溶液80g时,试通过计算,求此时烧杯中所得不饱和溶液中溶质的质量(计算结果精确至0.1g).
【答案】
(1)②
(2)富集镁元素
(3)NaCl、NaOH;恰好反应时反应的氢氧化钠的质量为:80g×20%=16g 设混合物中MgCl2的质量为x,反应生成NaCl的质量为y
MgCl2+ | 2NaOH═Mg(OH)2↓+ | 2NaCl |
95 | 80 | 117 |
x | 16g | y |
![]() ?? 解得:x=19g,y=23.4g所以,杯中所得不饱和溶液中溶质的质量是:(25g﹣19g)+23.4g=29.4g.答:烧杯中所得不饱和溶液中溶质的质量为29.4g.
?? 解得:x=19g,y=23.4g所以,杯中所得不饱和溶液中溶质的质量是:(25g﹣19g)+23.4g=29.4g.答:烧杯中所得不饱和溶液中溶质的质量为29.4g.
【解析】解:(1)由反应的流程可知,在②中氢氧化镁与盐酸的反应属于酸与碱发生的中和反应;(2)海水或卤水均含有氯化镁,氯化镁溶解在海水中,不能直接提取出来,经过①、②两个步骤将海水中的镁离子提取出来,得到纯净的氯化镁,然后电解才能得到镁.(3)①根据曲线可知,当滴入80gNaOH溶液时,MgCl2完全反应,生成氯化钠和氢氧化镁沉淀,当滴入上述NaOH溶液至图中B点时,氢氧化钠是过量的,溶液中的溶质是:NaCl、NaOH;
故答为:(1)②;(2)富集镁元素;(3)①NaCl、NaOH;
【考点精析】通过灵活运用中和反应及其应用和根据化学反应方程式的计算,掌握中和反应:酸与碱作用生成盐和水的反应;各物质间质量比=系数×相对分子质量之比即可以解答此题.

【题目】氧气在日常生活和T业生产中的用途非常广泛,其实验室的制取是化学研究的重要内容。
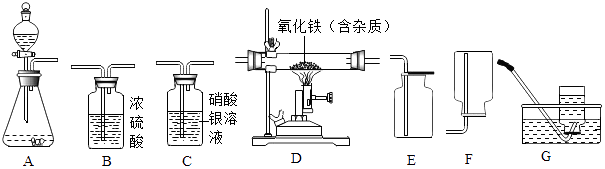
(1)根据下列实验装置图回答问题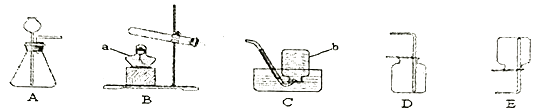
①写出标有字母的仪器名称:a ,b 。
②写出A装置制取O2的化学方程式 。
③若装置D收集氧气,验满的方法是 。
(2)实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的化学方程式: ;
(3)小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除MnO2 , CuO外,Fe2O3 , 也可以作KClO3分解的催化剂。
【实验验证】按下表进行实验:经测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度( |
① | KClO3 | 580 |
② | KClO3、MnO2质量比1:1) | 350 |
③ | KClO3 , CuO(质量比1:1) | 370 |
④ | KClO3、Fe2O3(质量比1:1) | 390 |
【分析数据、得出结论】由实验与实验④对比,证明猜想合理。
(4)【拓展延伸】如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?
(5)【实验反思】同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证 。
(6)在实验室中用高锰酸钾制取氧气,若产生9.6克氧气需要分解克高锰酸钾?