��Ŀ����
����Ŀ����ͼΪʵ�����г����������Ʊ����������ռ�������ʵ��IJ��������� 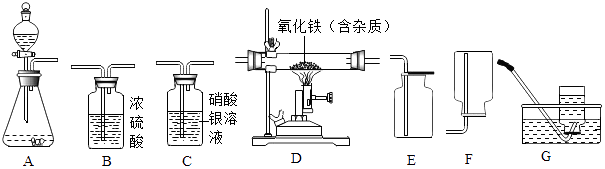
��1������ʯ��ʯ��ϡ����Ϊԭ����ȡ������̼���壬�������ӷ����������Ȼ������壬������ȡ�����岻������Ҫ�ռ�һƿ�Ƚϴ�������Ķ�����̼���壮 ����ѡ����������˳��Ϊ����д���������ĸ����
�����ɶ�����̼ʱ����������Ӧ�Ļ�ѧ����ʽΪ ��
��ʵ������ȡ������̼���ʣ���Һ�г������������ᣬ���ڲ������ָʾ���������¼���ij��ҩƷ��ȥ���е����ᣬ�õ��ϴ���������Һ�壬��Ӵ����ʯ�ҡ�ʯ��ʯ����������ѡ�õ�һ���Լ��� �� �����ʵ����� ��
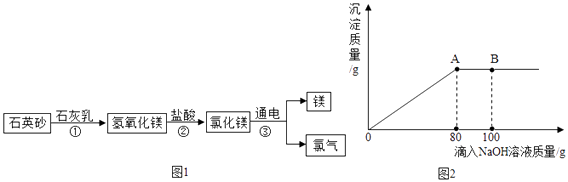
��2����װ��A��ʢ��п����ϡ���ᣬСӱͬѧ�������Ʊ����������ⶨ10g��������Ʒ���������Ĵ��ȣ����ʲ���Ӧ������������˳��Ϊ��A��B1��D��B2��B3 �� ����֪��Fe2O3+3H2 ![]() 2Fe+3H2O������B1��B2��B3Ϊ3��Ũ����ϴ��ƿ�� ��ʵ�鿪ʼʱ��Ҫ��ͨһ���H2�ټ��ȣ������� ��
2Fe+3H2O������B1��B2��B3Ϊ3��Ũ����ϴ��ƿ�� ��ʵ�鿪ʼʱ��Ҫ��ͨһ���H2�ټ��ȣ������� ��
����װ���в�����B1 �� ��B2װ���ڷ�Ӧǰ�����������ӽ��м��㣬��������� �� ��ѡ�ƫ����ƫС����������Ӱ�족֮һ��
�������B2���ӵ�����Ϊag�������Ʒ��������������Ϊ �� ����Ϊ������ʽ��
���𰸡�
��1��ACBE��CaCO3+2HCl=CaCl2+H2O+CO2����ʯ��ʯ����ʣ���Һ�м�������ʯ��ʯ��ĩ,��ַ�Ӧ������������ð��,����,��Һ��Ϊ�ϴ���������Һ��
��2���ų�װ���еĿ���,��ֹ����ʱ������ը��ƫ�� ![]()
���������⣺��1����ʵ������Ũ�����ʯ��ʯ��ȡ�Ķ�����̼�л����Ȼ��⡢ˮ�������������������ᷴӦ��Ũ��������ˮ�ԣ���ȥˮ������Ҫ�����������̼���ܶȱȿ�����������ѡ����������˳��ӦΪACBE����̼��ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼����ѧ����ʽΪ��CaCO3+2HCl=CaCl2+H2O+CO2�����۴����ʯ���ڹ���������£���Һ�Լ��ԣ���Ҫ����ָʾ������ȷ��ǡ����ȫ��Ӧ������ѡ�õ�һ���Լ���ʯ��ʯ��ʵ������ǣ���ʣ���Һ�м�������ʯ��ʯ��ĩ����ַ�Ӧ������������ð�������ˣ���Һ��Ϊ�ϴ���������Һ�壻��2���������������Ļ�����ڵ�ȼ�������¿��ܷ�����ը������ʵ�鿪ʼʱ��Ҫ��ͨһ���H2�ټ��ȣ������ǣ��ų�װ���еĿ�������ֹ����ʱ������ը��������B1������������ˮ���������ӻᵼ��ˮ�����������Ľ��ƫ�������Ʒ��������������Ϊx
Fe2O3+3H2 | 2Fe+ | 3H2O |
160 | 112 | 54 |
x | ag |
![]() =
= ![]()
x= ![]()
���Դ��ǣ���1����ACBE����CaCO3+2HCl=CaCl2+H2O+CO2������ʯ��ʯ����ʣ���Һ�м�������ʯ��ʯ��ĩ����ַ�Ӧ������������ð�������ˣ���Һ��Ϊ�ϴ���������Һ�壻��2�����ų�װ���еĿ�������ֹ����ʱ������ը����ƫ�� ![]() ��
��
�����㾫�����������⣬������Ҫ�˽���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ(ע�⣺a����ƽ b������ c������)����Ҫ���������Ļ�ѧ������ȼ��ʵ��(��ѧ���ʣ���ȼ�ԣ���;������ȼ�ϣ������溸�ӣ��и����������ԭ�ԣ���;��ұ����������С����п�ȼ�ԣ����л�ԭ�Ե����ʡ�H2��C��CO��)�����֪ʶ���Ǵ���Ĺؼ���