题目内容
【题目】随州市某初中学校九年级化学兴趣小组学完“盐的性质”后进行下图两个实验。
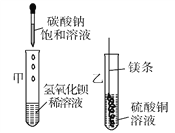
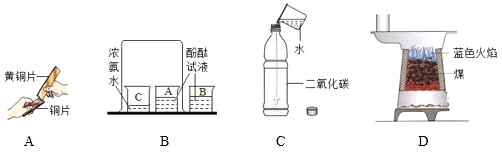
(1)甲实验中反应的化学方程式为__________________。
(2)乙实验观察到的现象是________________________。
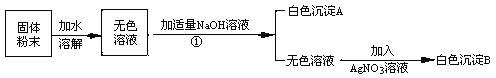
(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
(查阅资料)硫酸钡不溶于酸。
(作出猜想)白色沉淀为:Ⅰ._____________;
Ⅱ.Mg(OH)2和BaSO4;Ⅲ. Mg(OH)2和MgCO3。
(实验方案)请你设计一种实验方案证明猜想Ⅲ成立。
实验操作 | 实验现象与结论 |
_________________ | _____________________,猜想Ⅲ成立。有关化学反应方程式为:(写一个即可)________________。 |
(拓展与思考)如果猜想Ⅱ成立,产生此结果的原因是做甲实验时__________________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是____________。
【答案】 Ba(OH)2+Na2CO3 =2NaOH+BaCO3↓ 镁条表面覆盖红色固体,溶液由蓝色变成无色 Mg(OH)2 取少量白色沉淀于试管中,加入足量稀盐酸 沉淀全部消失且有气泡产生 2HCl+BaCO3 =BaCl2+H2O+CO2↑ Ba(O H)2过量 甲中的碳酸钠和氢氧化钡反应,不可能同时剩余
【解析】根据所学知识和题中信息知,(1)甲实验中反应的化学方程式为Ba(OH)2+Na2CO3=2NaOH+BaCO3↓。(2)乙实验观察到的现象是镁条表面覆盖红色固体,溶液由蓝色变成无色,镁比铜活泼,镁与硫酸铜溶液反应置换出铜。(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成。【作出猜想】白色沉淀为:Ⅰ是Mg(OH)2;Ⅱ.Mg(OH)2和BaSO4;Ⅲ. Mg(OH)2和MgCO3。【实验方案】
实验操作 | 实验现象与结论 |
取少量白色沉淀于试管中,加入足量稀盐酸 | 沉淀全部消失且有气泡产生,猜想Ⅲ成立。有关化学反应方程式为2HCl+BaCO3 =BaCl2+H2O+CO2↑。 |
【拓展与思考】如果猜想Ⅱ成立,产生此结果的原因是Ba(O H)2过量;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是做甲实验时甲中的碳酸钠和氢氧化钡反应,不可能同时剩余。
点睛∶镁比铜活泼,镁与硫酸铜溶液反应置换出铜。碳酸钠和氢氧化钡反应,不可共存。硫酸钡不溶于酸。

【题目】煤和天然气是是当今社会重要的能源。
(1)写出天然气中甲烷完全燃烧的化学方程式_____
(2)天然气属于_____能源(填“可再生”或“不可再生”),分析下表,与煤相比,用天然气作燃料的优点有_____。
1g 物质完全燃烧 | ||
产生二氧化碳的质量/g | 放出的热量/KJ | |
甲烷 | 2.75 | 56 |
碳 | 3.67 | 32 |
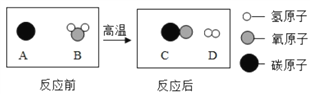
(3)为提高煤的利用率,可将其转化为可燃性气体,该反应的微观示意图如下,写出该反应化学方程式_______;
(4)液态二氧化碳可用于扑救档案室发生的火灾,下列说法不正确的是________填字母序号)。
A.液态二氧化碳汽化后不会污染档案 B.二氧化碳可覆盖在可燃物表面,隔绝空气 C.液态二氧化碳汽化时吸热,降低可燃物的着火点
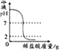
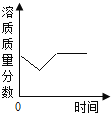
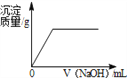
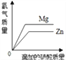
【题目】下列图像能正确反映对应变化关系的是( )
A | B | C | D |
向一定量的氢氧化钠溶液中逐滴加入pH = 2的稀盐酸 | 某温度时,向一定量的饱和石灰水中加入少量生石灰 | 向含有稀盐酸和氯化铁的混合溶液中滴加烧碱溶液 | 相等质量的镁、锌中分别加入同浓度的稀硫酸 |
| .. |
|
|
A. A B. B C. C D. D
【题目】化学就在我们身边,它与我们的生活息息相关。当今社会,随着汽车数量的急剧增加,能源和环保问题日趋严峻,用电力驱动代替燃油的电动汽车被称为“未来汽车”。请回答下列问题:

(1)图中标示物属于金属材料的是_____ (填序号),属于合成材料的是______(填序号)
(2)汽车制造要使用大量的钢铁,请写出以赤铁矿为原料炼铁的化学方程式_________。
(3) 铬(Cr)为不锈钢主要的添加的元素。比较Cr的金属活动性强弱。相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入________________相同的足量稀盐酸中(生成物中Cr显+2价),现象如下:
金属 | Cr | Mg |
与盐酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 |
①上述三种金属的活动性由强到弱的顺序是_______________。
②从上述实验可知,Cr能跟CuSO4溶液反应,方程式是____________