题目内容
【题目】有一包白色粉末可能由NaCl、NaNO3、MgCl2、CuSO4、中的一种或多种物质组成。小明为了探究其成分,设计并完成了如下图所示的实验。
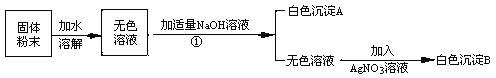
根据以上实验,回答:
操作①是
原固体粉末中一定没有的成分是
生成沉淀A的化学方程式是
根据上述实验 (填‘能’或‘不能’)确定原固体粉末中含有NaCl、NaNO3。
【答案】(1)过滤 (2)硫酸铜(3)2NaOH+MgCl2==Mg(OH)2↓+2NaCl (4)不能
【解析】
试题分析:(1)根据图示可知:操作①将前面的混合物分离成白色沉淀和无色溶液两部分,即分离不溶性固体和液体。所以此操作为过滤。
(2)根据图示可知:固体粉末加水溶解后,可得到无色溶液,即溶液中不含有色物质。在题目所给的物质中,硫酸铜溶解于水会形成蓝色溶液,与题意不符。所以原固体粉末中一定不含硫酸铜。
(3)白色沉淀是由固体粉末溶解于水后与氢氧化钠反应生成的。根据题意可知,只有氯化镁可与氢氧化钠反应生成氢氧化镁沉淀和氯化钠。反应的化学方程式为:2NaOH+MgCl2==Mg(OH)2↓+2NaCl
(4)根据上述推测可知:固体中一定会存在氯化镁,所以无色溶液中含氯化镁与氢氧化钠反应生成的氯化钠。当再加入硝酸银时,可与其反应生成氯化银沉淀。符合题意产生白色沉淀B。因此无法确定原混合物中是否含氯化钠。硝酸钠在题目中的操作中不发生变化,无法确认是否存在。所以无法确定原固体粉末中是否含氯化钠和硝酸钠。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如下表,请分析计算:
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/g | 0 | 0 | m | n |
(1)反应后,稀盐酸还有剩余的是第________组;
(2)求混合物中碳酸钙和氯化钙的质量之比________;
(3)求表中a的值为________;
(4)求表中m的值____。
【题目】某校同学开展了如下“溶液酸碱性的检验”的实验活动:

(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 | 白醋 | 盐酸 | 蔗糖水 | 草木灰水 | 石灰水 |
加入紫薯汁 后的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
①图1中存放紫薯汁的仪器名称:________;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是________;
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于________(填“酸性”“中性”或“碱性”)溶液,白醋pH________(填“>”“<”或“=”)7;
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是________(填“A”“B”或“C”,下同),可能导致被测溶液pH数值发生改变的错误操作是________。