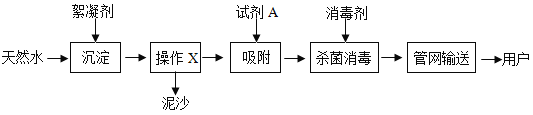
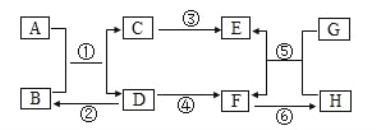
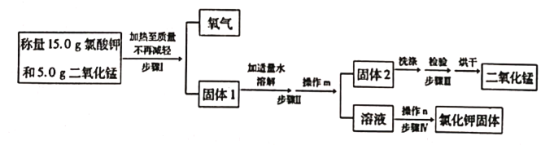
题目内容
【题目】常见铁的氧化物有三种:FeO、 Fe3O4、Fe2O3,根据下列要求填空
(1)FeO的名称是_________
(2)三种物质中氧元素质量分数最大的是__________
(3)写出铁在氧气中燃烧的化学方程式_________
(4)Fe3O4中铁元素既有+2价,又有+3价,则+2、+3价的铁原子个数比为._________
(5)比较等质量的金属所含原子个数:铁____镁 (填“>”,“<”或“=”)
【答案】氧化亚铁 FeO 3Fe + 2O2 ![]() Fe3O4 1:2 <
Fe3O4 1:2 <
【解析】
(1)FeO中铁元素显+2价,读作:氧化亚铁;
(2)设铁的氧化物通式为FeOx,则Fe的质量分数=![]() ,x值越小,铁的质量分数越大,将FeO、 Fe3O4、Fe2O3分别变形为
,x值越小,铁的质量分数越大,将FeO、 Fe3O4、Fe2O3分别变形为![]() ,因为
,因为![]() ,所以可推知三种铁的氧化物中,三种物质中氧元素质量分数最大的是FeO;
,所以可推知三种铁的氧化物中,三种物质中氧元素质量分数最大的是FeO;
(3)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe + 2O2 ![]() Fe3O4;
Fe3O4;
(4)Fe3O4可改写为:FeO·Fe2O3,Fe3O4中显+2价、+3价的铁原子个数比为1:2;
(5)镁的相对原子质量小于铁的相对原子质量,所以等质量的金属含原子个数:铁小于镁;故填:<。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】蔗糖是生活中常见的一种物质,某兴趣小组对“蔗糖的组成”进行了探究。
[作出猜想]小组同学认为绿色植物通过光合作用将二氧化碳和水转化成葡萄糖和氧气,葡萄糖进一步转化为蔗糖,故蔗糖中- -定含有碳、 氢元素,可能含有氧元素。
{实验验证]方案一:小明将蔗糖在氧气中燃烧,检验生成物中有水和二氧化碳,得出结论“蔗糖是由碳、氢、氧三种元素组成的”。
小刚认为该方案不合理,只能说明蔗糖中一定含有碳、氢元素,不能确定是否含有氧元素,理由是_________
方案二:小刚用下图所示装置进行实验,实验开始先通入一会儿氮气, 然后关闭弹簧夹,点燃酒精灯给蔗糖加强热。
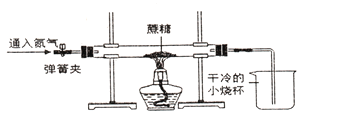
(1)观察到______________出现,说明蔗糖中含有氢元素和氧元素。
(2)观察到硬质玻璃管中残留有黑色固体,他猜测该黑色固体是单质碳,并继续利用如图所示装置,另选试剂进行了验证单质碳的实验。实验过程和现象如表:
实验过程 | 实验现象 |
______,再点燃酒 精。 | ① 硬纸玻璃管中的黑色固体剧烈燃烧,发出白光: ② _________. |
写出上述实验过程中②反应的化学方程式: _________.
[实验结论]蔗糖是由碳、氢、氧三种元素组成的。
[拓展交流]方案二中,先通一会儿氮气的原因是__________.
【题目】化学学习小组的同学们在用如图所示装置做木炭还原氧化铜实验时。发现试管中足量的澄清石灰水变浑浊,且有气泡不断冒出,于是同学们得出“木炭和氧化铜反应有二氧化碳生成”的结论。
小明同学提出如下质疑:
①木炭在高温下与试管内空气中的氧气反应也能产生二氧化碳,那么,澄清的石灰水变浑浊,不能说明二氧化碳一定是木炭和氧化铜反应产生的。
②石灰水中不断有气泡冒出,是什么气体呢?
根据小明的质疑,同学们进行了如下探究:
探究一:碳能否与氧化铜反应产生二氧化碳。
(设计实验)同学们将上述装置进行改进,设计了如甲图装置进行实验:
(主要实验步骤)
(1)组装仪器,检查装置的气密性。
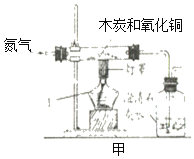
(2)在硬质玻璃管中装入氧化铜和木炭粉的混合物,集气瓶中放入足量澄清石灰水。
(3)通入一会儿氮气,目的是_____。再加热,酒精灯加网罩的作用是_____,观察现象。硬质玻璃管中的现象是_____。澄清的石灰水变浑浊。
(得出结论)碳能与氧化铜反应产生二氧化碳。
探究二:石灰水中不断冒出的是什么气体?
(猜想和假设)猜想一:CO2 猜想二:CO 猜想三:_____。
(查阅资料)CO气体能使湿润的黄色氯化钯试纸变蓝色。
(设计实验)根据各自的猜想,他们共同设计了如图乙所示的装置进行探究:装置A中放入一定比例的木炭粉和氧化铜的混合物,B、C中均放入澄清的石灰水,且B中石灰水保证足量,D中放入湿润的氯化钯试纸。
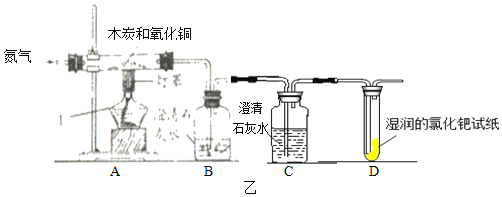
(现象与分析)
现象 | 结论 |
_____。 | 猜想三正确 |
(反思)
(1)同学们对CO产生的原因进行了
①原因一:木炭和氧化铜在高温条件下直接发生反出产生CO;
②原因二:反应C+2CuO![]() 2Cu+CO2↑中的一种产物和反应物木炭又发生了化学反应,产生了CO;
2Cu+CO2↑中的一种产物和反应物木炭又发生了化学反应,产生了CO;
请你从原因一、原因二中选择其一,用化学方程式表示存在此原因的化学反应原理_____。
由此,同学们想到乙图装置设计中存在缺陷,改进方法是_____。
(2)上图装置乙中B瓶中放入足量澄清石灰水,完全可以吸收装置A中产生的二氧化碳,为什么B瓶中冒出的气体还含有二氧化碳呢?同学们经过讨论认识到:A中溢出的气体气流比较急,且导管较细,部分生成的二氧化碳未与石灰水反应,便在气流的作用下溢出了。