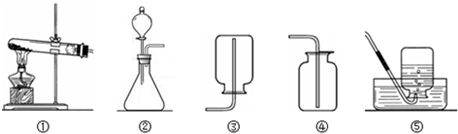
题目内容
现有下列装置,回答问题:
 |
(1)写出有标号仪器的名称:① ▲ ;
(2)检查B装置的气密性的方法是: ▲ ,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室制取H2的反应化学方程式为 ▲ ,发生装置为 ▲ ;
(4)实验发现:用40%的硫酸制取H2效果最好。现欲配制30mL 40%(密度为1.30g·mL—1)的硫酸,需要98%(密度为1.84g·mL—1)的浓硫酸 ▲ mL(精确到小数点后一位),需要水 ▲ mL(精确到小数点后一位)。量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 ▲ 40%(填“>”或“=”或“<”),配制过程不需要的仪器是 ▲ ;
A.托盘天平 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.铁架台
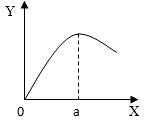
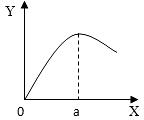 (5)实验室制取H2时,在硫酸溶液中滴入饱和CuSO4溶液会影响反应速率。右图是滴入饱和CuSO4溶液体积(X)与反应速率(Y)的关系图,请回答:
(5)实验室制取H2时,在硫酸溶液中滴入饱和CuSO4溶液会影响反应速率。右图是滴入饱和CuSO4溶液体积(X)与反应速率(Y)的关系图,请回答:
①滴入CuSO4溶液后,发生反应的化学方程式为 ▲ ;
②a点过后,反应速率降低的原因可能是 ▲ 。
(1)铁架台 (2)堵住右侧导气管 (3)Zn + H2SO4 == ZnSO4 + H2↑ (或
Zn+2HCl=ZnCl2+ H2↑) B (4)8.7 23.0(或23.1) > AF (共1分,全对得1分)
(5)①Zn + CuSO4 == ZnSO4 + Cu ②生成的Cu覆盖在Zn表面,阻止反应进一步进行(或硫酸浓度变小,使反应速率降低)

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
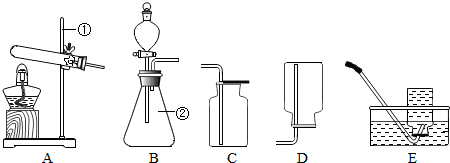
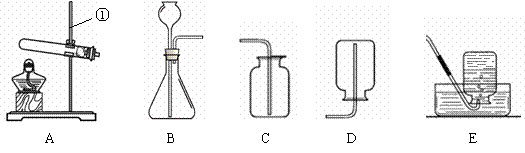
浙江之星学业水平测试系列答案现有下列装置,回答问题:
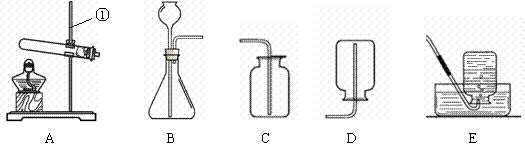 |
(1)写出有标号仪器的名称:① ▲ ;
(2)检查B装置的气密性的方法是: ▲ ,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室制取H2的反应化学方程式为 ▲ ,发生装置为 ▲ ;
(4)实验发现:用40%的硫酸制取H2效果最好。现欲配制30mL 40%(密度为1.30g·mL—1)的硫酸,需要98%(密度为1.84g·mL—1)的浓硫酸 ▲ mL(精确到小数点后一位),需要水 ▲ mL(精确到小数点后一位)。量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 ▲ 40%(填“>”或“=”或“<”),配制过程不需要的仪器是 ▲ ;
A.托盘天平 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.铁架台
(5)实验室制取H2时,在硫酸溶液中滴入饱和CuSO4溶液会影响反应速率。右图是滴入饱和CuSO4溶液体积(X)与反应速率(Y)的关系图,请回答:
①滴入CuSO4溶液后,发生反应的化学方程式为 ▲ ;
②a点过后,反应速率降低的原因可能是 ▲ 。