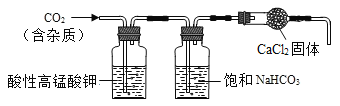
题目内容
【题目】(1)明明用配制的氢氧化钠溶液做中和反应实验,发现有气泡产生。于是明明判断氢氧化钠变质了。请用化学方程式说明氢氧化钠变质以及滴加盐酸产生气泡的原因_____。
(2)为探究氢氧化钠是否完全变质,明明设计了两个实验方案。
方案1:取少量上述氢氧化钠溶液样品,滴加几滴酚酞溶液,溶液变成红色。
方案2:取少量上述氢氧化钠溶液样品,加入饱和石灰水,静置,取上层清液,滴加几滴酚酞溶液。发现溶液变成红色。于是明明认为样品中还会有氢氧化钠,没有完全变质。康康认为明明的两个实验方案都不能达到目的,他的理由是_____;_____。
请你设计一个方案来验证氢氧化钠是否完全变质_____。
(3)康康将方案 2 进行了定量化处理,来检测氢氧化钠固体的变质程度。取 10 g 样品溶于 90 g水中,向其中滴加过量饱和石灰水,对沉淀过滤、洗涤、烘干后称量为 0.5 g。则样品中氢氧化钠的质量分数是多少?_____
【答案】2NaOH+CO2═Na2CO3+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑ 可能是氢氧化钠也可能是碳酸钠使酚酞变红 氢氧化钙会与碳酸钠反应产生氢氧化钠,能使酚酞试液变红 取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液,静置,取上层清液,滴加几滴酚酞试液,发现溶液不变色 94.7%
【解析】
(1)氢氧化钠变质是因为氢氧化钠能与二氧化碳反应生成碳酸钠和水,滴加盐酸产生气泡是因为碳酸钠能与盐酸反应产生氯化钠、水和二氧化碳,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)方案1:碳酸钠溶液和氢氧化钠溶液均显碱性,都可以使无色酚酞变红。取少量上述氢氧化钠溶液样品,滴加几滴酚酞溶液,溶液变成红色,可能是氢氧化钠也可能是碳酸钠使酚酞变红;
方案2:取少量上述氢氧化钠溶液样品,加入适量饱和石灰水,氢氧化钙会与碳酸钠反应产生氢氧化钠,能使酚酞试液变红;因此明明认为样品中还有氢氧化钠,样品没有完全变质的说法是错误的;
要设计一个实验方案来验证氢氧化钠是否完全变质,可以取少量上述氢氧化钠溶液样品,加入足量氯化钙溶液(目的是除尽碳酸钠),静置,取上层清液,滴加几滴酚酞试液,发现溶液不变色,说明无氢氧化钠存在,样品已经完全变质;
(3)设样品中碳酸钠的质量为x,
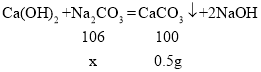
![]()
x=0.53g
故样品中氢氧化钠的质量分数是:![]() ×100%=94.7%。
×100%=94.7%。