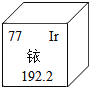
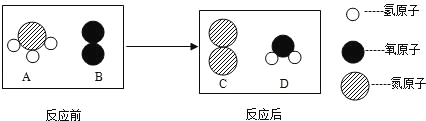
��Ŀ����
����Ŀ��ľ̿�ۻ�ԭ����ͭʵ���Ļ�Ϸ�ĩ�к���ͭ������ͭ������ľ̿�ۣ�ʵ���ҴӸû�Ϸ�ĩ�л���ͭ�ķ�����ͼ��
(1)д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ�٣�___��
��Ӧ�ڣ�___��___��
(2)��Ӧ�����õ��������������Ϊ24.5%����Ҫ����40g24.5%�����ᣬ��Ҫ___g98%��Ũ���ᣮ
(3)�ڽ�������Ӧ����������Ӧ����������Ӧ�����IJ���ʱ���ɽ���Ӧ������ձ��У�Ȼ����___(����������)���Ͻ��裬ʹ��Ӧ��ֽ��У�
(4)�Լ�A��ѡ��___��Һ(�ѧʽ)��
���𰸡�H2SO4+CuO�TCuSO4+H2O Fe+H2SO4�TFeSO4+H2�� Fe+CuSO4�TFeSO4+Cu 10g ������ H2SO4
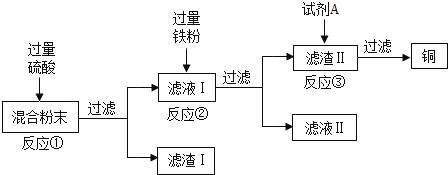
��������
(1)������ͭ�����ᷴӦ��������ͭ��ˮ��ͭ��ľ̿�������Ӧ���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��H2SO4+CuO�TCuSO4+H2O��
�ڹ��˺����Һ��������ͭ��ʣ���ϡ���ᣬ�������ۺ�����ͭ�����۷�Ӧ��������������ͭ��ϡ���������۷�Ӧ���������������������ʷ�Ӧ�Ļ�ѧ����ʽдΪ��Fe+CuSO4�TFeSO4+Cu��Fe+H2SO4�TFeSO4+H2����
(2)��Ҫ98%�����������Ϊ![]() ������10��
������10��
(3)Ϊ�˼ӿ췴Ӧ���ʿ��ò��������Ͻ��裬���������
(4)�������к���ʣ������ۺ����ɵ�ͭ�ۣ��������ᷴӦ����������������������ͭ�������ᷴӦ����˿ɼ��������ȥ��������H2SO4��

����Ŀ���ճ������У���������̼������Һ���м��ԣ���ϴ�;��ϵ����ۣ�����Խǿ��ȥ���۵�Ч��Խ�á�����ʵ����Ӱ��̼������Һ���Ե�����չ��̽������̼���ƹ���Ͳ�ͬ�¶ȵ�ˮ�������������������ֱ�Ϊ 2%��6%��10%��̼������Һ������������Һ��pH����¼���±�:
ʵ���� | �� | �� | �� | �� | �� | �� | �� | �� | �� |
������������ | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
ˮ���¶�/��C | 20 | 40 | 60 | 20 | 40 | 60 | 20 | 40 | 60 |
��Һ pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | 11.46 | 11.50 |
��1��ȥ���۵�Ч����õ���___________ (��ʵ����)��
��2�� ��һ���¶ȷ�Χ�ڣ��¶ȶ�̼������ҺpH��Ӱ����:��_______��ͬʱ��______��
��3�����ijʵ��С����õ����õ�ȥ��Ч��������֮ǰ��ʵ����ɣ����Գ��Ե�ʵ��������__________________
A 12%�� 60��C B 8%�� 40�� C C 10%�� 70��C
��4��̼������Һ�ʼ��Ե�ԭ���ǣ�һ����̼�������ˮ�����̼��������Ӻ����������ӣ��ٲ���̼���������ˮ�����̼������������ӡ�����100g10%̼������Һ��̼Ԫ�ص�������_________g(��ȷ��0.1)