题目内容
工业上可采用多种方法冶炼铜。
(1)在地下利用爆破粉碎孔雀石[Cu2(OH)2CO3],再注入稀硫酸原地浸取,将浸取液抽到地表,加入铁屑制得铜。
冶炼铜的有关化学方程式为 ① 、 ② 。
(2)利用一氧化碳还原赤铜矿(Cu2O)冶炼铜。
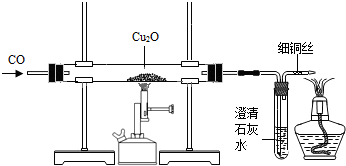
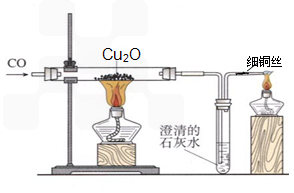
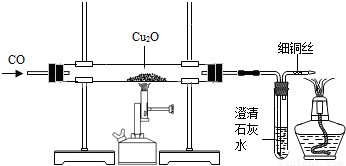
实验室可用右图所示装置进行实验。
当硬质玻璃管中的反应结束时,应进行的实验操作是 ① ;尾气导管口处的细铜丝,能防止点燃尾气时产生回火引起爆炸,其原理是 ② 。
(3)利用辉铜矿(Cu2S)冶炼铜的原理如下:
Ⅰ.取一定质量的Cu2S在空气中高温焙烧,安全反应后生成一种铜的氧化物和二氧化硫;
Ⅱ.再取上述一半质量的Cu2S,与Ⅰ中生成的铜的氧化物混合均匀,隔绝空气高温煅烧,恰好完全反应,生成铜和二氧化硫。
结合质量守恒定律,判断这种铜的氧化物是什么,写出推理过程。
⑴Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑、Fe + CuSO4 === FeSO4 + Cu
⑵继续通一氧化碳防止新生成的铜被二次氧化 铜丝有导热性,吸收部分热量,使温度达不到一氧化碳的着火点学科王
⑶该氧化物为Cu2O,
方法一① Cu2S + O2→ X+ SO2
② 2X+ Cu2S→ Cu+SO2
铜有Cu2O和CuO两种氧化物,每分子中氧原子个数为1, ②中因为二氧化硫中S、O个数比1:2,所以X与Cu2S个数比2:1,由题意知①中Cu2S为②中2倍,所以可将①配平如下
2Cu2S +3 O2→2X+2SO2
可知X为 Cu2O
方法二、
假设生成氧化铜
则①Cu2S + 2 O2= 2CuO+ SO2
② 2 CuO + Cu2S= 4Cu+SO2
②中Cu2S用量与①相同,与题意不符

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案