题目内容
(2012?大连)工业上可采用多种方法冶炼铜.
(1)在地下利用爆破粉碎孔雀石[Cu2(OH)2CO3],再注入稀硫酸原地浸取,将浸取液抽到地表,加入铁屑制得铜.冶炼铜的有关化学方程式为:
①
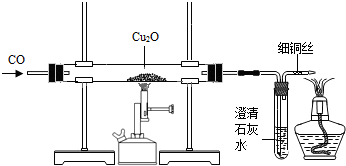
(2)利用一氧化碳还原赤铜矿(Cu2O)冶炼铜. 实验室可用如图所示装置进行实验.当硬质玻璃管中的反应结束时,应进行的实验操作是
(3)利用辉铜矿(Cu2S)冶炼铜的原理如下:
Ⅰ.取一定质量的Cu2S在空气中高温焙烧,安全反应后生成一种铜的氧化物和二氧化硫;
Ⅱ.再取上述一半质量的Cu2S,与Ⅰ中生成的铜的氧化物混合均匀,隔绝空气高温煅烧,恰好完全反应,生成铜和二氧化硫.
结合质量守恒定律,判断这种铜的氧化物是什么,写出推理过程.

(1)在地下利用爆破粉碎孔雀石[Cu2(OH)2CO3],再注入稀硫酸原地浸取,将浸取液抽到地表,加入铁屑制得铜.冶炼铜的有关化学方程式为:
①
Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑
Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑
;②CuSO4+Fe=Cu+FeSO4
CuSO4+Fe=Cu+FeSO4
.(2)利用一氧化碳还原赤铜矿(Cu2O)冶炼铜. 实验室可用如图所示装置进行实验.当硬质玻璃管中的反应结束时,应进行的实验操作是
应先停止加热,继续通一氧化碳,直到试管冷却
应先停止加热,继续通一氧化碳,直到试管冷却
;尾气导管口处的细铜丝,能防止点燃尾气时产生回火引起爆炸,其原理是2Cu+O2
2CuO
| ||
2Cu+O2
2CuO
.
| ||
(3)利用辉铜矿(Cu2S)冶炼铜的原理如下:
Ⅰ.取一定质量的Cu2S在空气中高温焙烧,安全反应后生成一种铜的氧化物和二氧化硫;
Ⅱ.再取上述一半质量的Cu2S,与Ⅰ中生成的铜的氧化物混合均匀,隔绝空气高温煅烧,恰好完全反应,生成铜和二氧化硫.
结合质量守恒定律,判断这种铜的氧化物是什么,写出推理过程.
分析:(1)根据碱式碳酸铜和稀硫酸反应生成硫酸铜、水二氧化碳以及硫酸铜和铁反应生成硫酸亚铁和铜进行解答;
(2)根据一氧化碳还原氧化铜的注意事项进行解答;
(3)根据取上述一半质量的Cu2S,说明Ⅰ和Ⅱ中铜的质量比为:2:1;然后Ⅱ与Ⅰ中生成的铜的氧化物混合均匀,隔绝空气高温煅烧,恰好完全反应,生成铜和二氧化硫,计算出铜和氧原子个数比进行解答.
(2)根据一氧化碳还原氧化铜的注意事项进行解答;
(3)根据取上述一半质量的Cu2S,说明Ⅰ和Ⅱ中铜的质量比为:2:1;然后Ⅱ与Ⅰ中生成的铜的氧化物混合均匀,隔绝空气高温煅烧,恰好完全反应,生成铜和二氧化硫,计算出铜和氧原子个数比进行解答.
解答:解:(1)碱式碳酸铜和稀硫酸反应生成硫酸铜、水二氧化碳,化学方程式为:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;硫酸铜和铁反应生成硫酸亚铁和铜,化学方程式为:CuSO4+Fe=Cu+FeSO4;
(2)利用一氧化碳还原赤铜矿(Cu2O)冶炼铜. 实验室可用如图所示装置进行实验.当硬质玻璃管中的反应结束时,应进行的实验操作是:应先停止加热,继续通一氧化碳,直到试管冷却;尾气导管口处的细铜丝,能防止点燃尾气时产生回火引起爆炸,其原理是2Cu+O2
2CuO;
(3)取上述一半质量的Cu2S,说明Ⅰ和Ⅱ中铜的质量比为:2:1,即铜的物质的量的比2:1;设Ⅰ取的Cu2S的物质的量为2mol,则Ⅱ中Cu2S的物质的量为1mol,那么Ⅱ中Cu2S中硫的物质的量为1mol,取上述一半质量的Cu2S,与Ⅰ中生成的铜的氧化物混合均匀,隔绝空气高温煅烧,恰好完全反应,生成铜和二氧化硫,则硫的物质的量和氧的物质量比为1:2,说明Ⅰ中生成的铜的氧化物中氧的物质的量为2mol,Ⅰ中取的Cu2S中铜的物质的量为4mol,则生成的铜的氧化物中铜的物质的量:氧的物质的量=4mol:2mol=2:1,所以这种铜的氧化物为氧化亚铜,化学式为:Cu2O.
故答案为:(1)Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;CuSO4+Fe=Cu+FeSO4;
(2)应先停止加热,继续通一氧化碳,直到试管冷却;2Cu+O2
2CuO;
(3)Cu2O;上述一半质量的Cu2S,说明Ⅰ和Ⅱ中铜的质量比为:2:1,即铜的物质的量的比2:1;设Ⅰ取的Cu2S的物质的量为2mol,则Ⅱ中Cu2S的物质的量为1mol,那么Ⅱ中Cu2S中硫的物质的量为1mol,取上述一半质量的Cu2S,与Ⅰ中生成的铜的氧化物混合均匀,隔绝空气高温煅烧,恰好完全反应,生成铜和二氧化硫,则硫的物质的量和氧的物质量比为1:2,说明Ⅰ中生成的铜的氧化物中氧的物质的量为2mol,Ⅰ中取的Cu2S中铜的物质的量为4mol,则生成的铜的氧化物中铜的物质的量:氧的物质的量=4mol:2mol=2:1,所以这种铜的氧化物为氧化亚铜.
(2)利用一氧化碳还原赤铜矿(Cu2O)冶炼铜. 实验室可用如图所示装置进行实验.当硬质玻璃管中的反应结束时,应进行的实验操作是:应先停止加热,继续通一氧化碳,直到试管冷却;尾气导管口处的细铜丝,能防止点燃尾气时产生回火引起爆炸,其原理是2Cu+O2
| ||
(3)取上述一半质量的Cu2S,说明Ⅰ和Ⅱ中铜的质量比为:2:1,即铜的物质的量的比2:1;设Ⅰ取的Cu2S的物质的量为2mol,则Ⅱ中Cu2S的物质的量为1mol,那么Ⅱ中Cu2S中硫的物质的量为1mol,取上述一半质量的Cu2S,与Ⅰ中生成的铜的氧化物混合均匀,隔绝空气高温煅烧,恰好完全反应,生成铜和二氧化硫,则硫的物质的量和氧的物质量比为1:2,说明Ⅰ中生成的铜的氧化物中氧的物质的量为2mol,Ⅰ中取的Cu2S中铜的物质的量为4mol,则生成的铜的氧化物中铜的物质的量:氧的物质的量=4mol:2mol=2:1,所以这种铜的氧化物为氧化亚铜,化学式为:Cu2O.
故答案为:(1)Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;CuSO4+Fe=Cu+FeSO4;
(2)应先停止加热,继续通一氧化碳,直到试管冷却;2Cu+O2
| ||
(3)Cu2O;上述一半质量的Cu2S,说明Ⅰ和Ⅱ中铜的质量比为:2:1,即铜的物质的量的比2:1;设Ⅰ取的Cu2S的物质的量为2mol,则Ⅱ中Cu2S的物质的量为1mol,那么Ⅱ中Cu2S中硫的物质的量为1mol,取上述一半质量的Cu2S,与Ⅰ中生成的铜的氧化物混合均匀,隔绝空气高温煅烧,恰好完全反应,生成铜和二氧化硫,则硫的物质的量和氧的物质量比为1:2,说明Ⅰ中生成的铜的氧化物中氧的物质的量为2mol,Ⅰ中取的Cu2S中铜的物质的量为4mol,则生成的铜的氧化物中铜的物质的量:氧的物质的量=4mol:2mol=2:1,所以这种铜的氧化物为氧化亚铜.
点评:解答本题要掌握化学方程式的书写方法,掌握根据实验现象判断实验实质的方法,只有这样才能对问题做出正确的判断.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目