题目内容
【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O + H2SO4 = CuSO4 + H2O + Cu
(进行实验)
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。

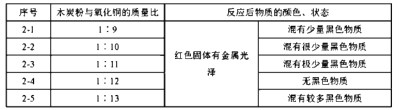
实验2:取一定量的混合物,用1—2装置进行实验。
(解释与结论)
(1)配平化学方程式:___C+___CuO高温 ___Cu+ ___CO2↑。
(2)实验1—2中,证明产生CO2的现象是_______________________。
(3)实验1的目的是__________。
(4)实验2的结论是_____________。
(反思与评价)
(5)实验2没有进行质量比为1:14的实验,理由是________________。
(6)为检验2—4的红色固体中是否含Cu2O,所需试剂是__________。
【答案】1 2 2 1; 澄清石灰水变浑浊; 探究木炭与氧化铜的受热面积对其反应的影响; 木炭与氧化铜质量比为1:12是恰好反应,因此木炭与氧化铜反应的最佳质量比为1:12; 木炭与氧化铜质量比为1:13时,氧化铜已过量; 稀硫酸。
【解析】
(1)木炭与氧化铜反应方程式:C+2CuO高温 2Cu+CO2↑;
(2)二氧化碳使澄清石灰水变浑浊,故如看到澄清石灰水变浑浊,说明有二氧化碳生成;
(3)实验1-1,反应物受热面积较大,实验1-2反应物受热面积较小,故实验1与实验2形成对比实验,可以探究木炭与氧化铜的受热面积对其反应的影响;
(4)由表可知,当木炭与氧化铜质量比为1:12是恰好反应,即木炭与氧化铜反应的最佳质量比为1:12;
(5)由表可知,当木炭与氧化铜质量比为1:13时,氧化铜已过量,生成物中含有Cu和CuO,没有必要进行质量比为1:14的实验;
(6)因为Cu2O + H2SO4 = CuSO4 + H2O + Cu,所以向红色固体中加稀硫酸如溶液变为蓝色,可以可以说明有Cu2O。