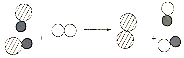题目内容
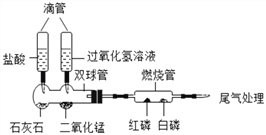
【题目】硫酸亚锡(SnSO4)广泛应用于电镀工业。该物质易与氧气反应而变质。实验室模拟工业上制取SnSO4的一种实验方案如下:
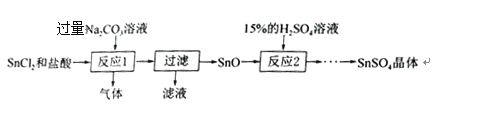
(1)SnCl2由Sn与盐酸反应制得,同时生成氢气,该反应的化学方程式为_____。
(2)Na2CO3俗称_____。
(3)过滤所得滤液中的溶质为_____(填化学式)。
(4)用已知质量分数和密度的浓硫酸配制质量分数为15%的稀硫酸,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_____。稀释浓硫酸的正确操作为_____。
(5)反应2属于基本反应类型中的_____反应。从反应2所得溶液中获得SnSO4晶体的部分操作须在隔绝空气条件下进行的原因是_____。
【答案】 Sn+2HCl=SnCl2+H2↑ 纯碱 SnCl2、NaCl、Na2CO3 量筒, 将浓硫酸沿烧杯壁慢慢注入水里,并用玻璃棒不断搅拌 复分解反应 防止SnSO4晶体与氧气反应而变质
【解析】
活泼金属与稀盐酸或稀硫酸反应生成盐和氢气,根据流程图可以推测滤液中的溶质,根据溶液稀释的基本步骤可知所需的实验仪器有哪些,基本反应类型是分解反应、化合反应、置换反应和复分解反应。
(1)锡和稀盐酸反应产生氯化亚锡和氢气,反应的化学方程式是Sn+2HCl=SnCl2+H2↑;(2)碳酸钠俗称是纯碱、苏打;(3)反应1有气体生成,是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以过滤之后的滤液中的溶质有氯化钠和氯化亚锡和过量的碳酸钠;(4)浓硫酸稀释的基本步骤为计算、量取、稀释,则需玻璃仪器有烧杯、玻璃棒、胶头滴管和量筒;稀释浓硫酸的正确操作是将浓硫酸沿烧杯壁慢慢注入水里,并用玻璃棒不断搅拌;(5)反应2是氧化亚锡和硫酸反应生成硫酸亚锡和水,是两种化合物互相交换成分生成另外两种化合物的反应,属于复分解反应;题干中硫酸亚锡易与氧气反应而变质,所以从反应2所得溶液中获得SnSO4晶体的部分操作须在隔绝空气条件下进行。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】某化学兴趣小组同学,用盐酸和氢氧化钠进行“酸碱中和反应”的探究,进行一段时间后发现没有明显变化,询问老师才知道忘记滴加指示剂。因此,他们停止实验,并在老师的指导下对烧杯内的溶液中的溶质的成分进行探究。
(提出问题)该烧杯内的溶质是什么?
(猜想假设)猜想一:NaCl 猜想二:NaCl和HCl
猜想三:NaCl和NaOH 猜想四:NaCl、NaOH和HCl
同学们讨论后一致认为猜想四不合理,请你说出不合理的理由______________________(用化学方程式表示)。
(查阅资料)NaCl溶液呈中性。
(实验探究)兴趣小组甲、乙、丙三位同学分别设计了如下的实验方案,请你帮助他们完成实验报告的相关内容。
实验方案 | 实验现象 | 实验结论 |
甲同学取少量烧杯内的溶液于试管中,滴入酚酞试液 | 溶液无变化 | 猜想一成立 |
乙同学另取少量烧杯内的溶液于试管中,加入_______。 | 有气泡生成 | 猜想二成立 |
丙同学另取少量烧杯内的溶液于试管中,滴加适量的CuSO4溶液 | 没有蓝色沉淀产生 | 猜想____不成立 |
(评价反思)老师看了甲、乙、丙三位同学的实验报告,指出甲同学的实验结论不准确,请你分析甲同学实验结论不准确的原因:___________。
(得出结论)猜想二成立
(拓展延伸)某同学在进行酸碱中和滴定实验时,测得溶液的pH变化如下图1所示,请回答下列问题:
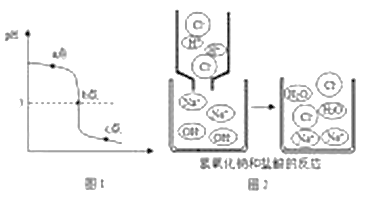
(1)由图1可知,该同学实验操作是________________。
A.将盐酸滴入氢氧化钠溶液中
B.将氢氧化钠溶液滴入盐酸中
(2)由图1可知,在b点处溶液中溶质是______________________。
(3)图2为盐酸和氢氧化钠溶液反应的微观过程,从微粒的角度分析,此反应的微观实质_______________(合理答案即可)。