题目内容
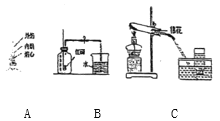
【题目】某粗盐样品中含有少量MgSO4和CaCl2杂质,某化学兴趣小组欲除去其中的杂质,得到纯净的NaCl晶体,设计了如图所示的实验方案。请回答下列问题:
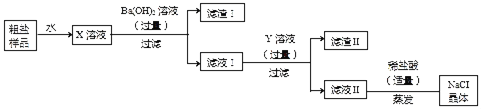
(1)写出X溶液与Ba(OH)2溶液反应的化学方程式_______。
(2)滤液I中溶质有哪些______________?
(3)该实验中最后加入适量稀盐酸的作用是什么_____________?
【答案】Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓;氢氧化钡、氯化钙;除去碳酸钠和氢氧化钠。
【解析】
(1)根据氢氧化钡和硫酸镁反应生成氢氧化镁沉淀和硫酸钡沉淀进行分析;
(2)根据加入的氢氧化钡是过量的,以及氢氧化钡发生的反应进行分析;
(3)根据除杂的过程加入的氢氧化钡是过量的,加入Y,需要出去氢氧化钡和氯化钙,所以Y是碳酸钠,反应生成的氢氧化钠和剩余的碳酸钠对于氯化钠是杂质进行分析。
(1)氢氧化钡和硫酸镁反应生成氢氧化镁沉淀和硫酸钡沉淀,化学方程式为:Ba(OH)2+MgSO4=BaSO4↓+Mg(OH)2↓;
(2)加入的氢氧化钡是过量的,以及氢氧化钡发生的反应,所以滤液I中溶质有:氢氧化钡、氯化钙;
(3)除杂的过程加入的氢氧化钡是过量的,加入Y,需要出去氢氧化钡和氯化钙,所以Y是碳酸钠,反应生成的氢氧化钠和剩余的碳酸钠对于氯化钠是杂质,所以该实验中最后加入适量稀盐酸的作用是:除去碳酸钠和氢氧化钠。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案【题目】竹子是“有节、中空、四季常绿”的植物(如图所示)。同学们对竹子中的气体成分展开了探究,测定其成分。
(提出猜想)猜想一:气体成分含有_____,猜想二:气体成分含有_____。
(1)收集竹子中的气体。
小华提出:将一节竹子浸没在水中,在竹子上钻孔,用排水法收集气体。
小刚提出:可用注射器从竹子中抽取气体。
大家认为两人的想法都可行,于是分为A、B两组,在相同条件下,A组采用小华的取气方法,B组采用小刚的取气方法,分别完成下面的实验。
(2)检验气体中是否含有二氧化碳气体。
实验步骤 | 实验现象 | 实验结论及解释 |
向所取得气体中加入: _____ | _____ | 有二氧化碳 |
(3)测定氧气含量。
(查阅资料)红磷的着火点为240℃,白磷的着火点为40℃。
(设计实验)同学们设计了如图所示的方案一和方案二来测定氧气含量。
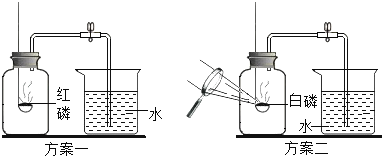
(进行实验)按上述两个方案进行多次实验。
(反思与评价)
a.实验中磷的量应为足量,原因是_____。
b.两个方案的实验测定结果不同,大家经讨论后一直认为方案_____(选填“一”或“二”)测定结果比较准确。原因是_____
c.经过A、B两组同学将收到的气体尽管都用比较准确的方案实验,但A的误差较大,小刚认为可能的原因是二氧化碳与水发生了化学反应,写出反应的化学方程式:_____。