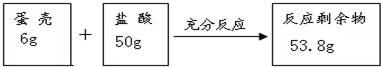
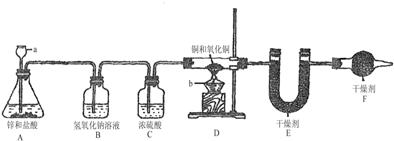
题目内容
某校化学兴趣小组对一种工业废水按下列步骤进行实验(假设能发生的反应均恰好完全反应):
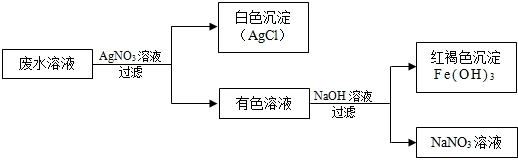
根据以上实验事实,用化学式回答:
(1)当废水溶液中仅含一种溶质时,该溶质是______.
(2)当废水溶液中仅含多种溶质时,除(1)中的溶质外,还可能存在的盐是______,______,______.

根据以上实验事实,用化学式回答:
(1)当废水溶液中仅含一种溶质时,该溶质是______.
(2)当废水溶液中仅含多种溶质时,除(1)中的溶质外,还可能存在的盐是______,______,______.
往废水中加入硝酸银溶液后有白色沉淀氯化银生成,说明原废水中一定含有Cl-,而在有色溶液中加入氢氧化钠溶液有红褐色沉淀Fe(OH)3和硝酸钠生成,说明有色溶液中一定含有硝酸铁,因此废水溶液中一定还有Fe3+,
在不影响图中现象的同时,废水还有可能含有钠离子、硝酸根离子,则当废水中仅含有一种溶质时,该溶质一定是FeCl3,而当废水中含有多种溶质时,还有可能含有硝酸钠、硝酸铁或氯化钠.古答案为:(1)FeCl3(2)NaNO3,NaCl,Fe(NO3)3
在不影响图中现象的同时,废水还有可能含有钠离子、硝酸根离子,则当废水中仅含有一种溶质时,该溶质一定是FeCl3,而当废水中含有多种溶质时,还有可能含有硝酸钠、硝酸铁或氯化钠.古答案为:(1)FeCl3(2)NaNO3,NaCl,Fe(NO3)3

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目