题目内容
某工业碳酸钠样品中混有少量氯化钠,为了测定样品的纯度,向12.0g样品中滴加稀盐酸至恰好完全反应,待二氧化碳气体不再放出后,去除溶液中的水分,最终得到13.1g氯化钠固体。试计算工业碳酸钠样品中Na2CO3的质量分数。(结果精确到0.1%)
88.3%
解析试题分析:稀盐酸与碳酸钠反应会生成氯化钠,即最终得到13.1g氯化钠固体包括两个部分:样品中原有的和生成的氯化钠,可通过假设未知数通过化学方程式利用物质反应的质量比求出样品中碳酸钠的质量。
【解】设:12g样品中含Na2CO3的质量为x,反应生成氯化钠的质量为y。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117
x y
106 /x =" 117" /y
y =" 117x" / 106
所得固体氯化钠的质量:12g-x+117x/106=13.1g
x=10.6g
该样品中含Na2CO3的质量分数为:10.6/12×100% = 88.3%
答:工业碳酸钠样品中Na2CO3的质量分数是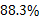 。
。
考点:根据化学反应方程式的计算

练习册系列答案
相关题目
小苏打(主要成分为NaHCO3)中常含有少量氯化钠。化学兴趣小组的同学为了测定某品牌小苏打中NaHCO3的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如下表所示。
| 物质 | 样品 | 消耗的稀盐酸 | 反应后的溶液 |
| 质量(g) | 9 | 75.4 | 80 |
(1)样品中的NaHCO3的质量分数;
(2)所得溶液中NaCl的质量分数。
浓硫酸是化学实验室的一种常用试剂,小王同学在实验室里观察到一瓶浓硫酸的标签,如下图
| 浓硫酸(500ml) 相对分子质量 98 溶质质量分数 98% 密度 1.84克/毫升 |
(1)小王在取用时不小心把浓硫酸滴在纸上,发现纸很快变黑炭化,这是发生了 变化。
(2)实验室经常需要把浓硫酸稀释成稀硫酸来使用,若浓硫酸和水的体积按1:4的比例稀释,所得稀硫酸的溶质质量分数是多少?
(3)实验后,小王没有把浓硫酸的瓶盖拧紧,久置后这瓶浓硫酸的溶质质量分数会变小,这是因为浓硫酸具有 。



