题目内容
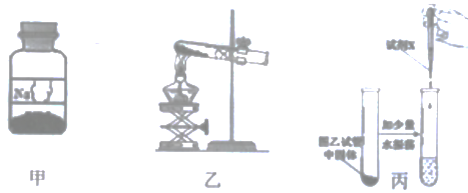
【题目】化学小组在帮助老师整理实验室的过程中,发现了如图甲所示的一瓶固体药品,其标签有部分残缺,经询问老师,得知该药品是初中化学常见的一种物质。
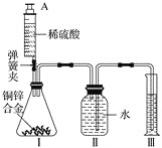
(1)实验一:探究瓶中药品的成分
(猜想与假设)根据残留的标签内容,小红认为瓶中药品可能是NaHCO3、Na2CO3、NaCl、Na2SO4、NaNO3中的一种,小明认为还可能是________。已知所有可能的物质中,只有小明猜测的物质和NaHCO3、Na,CO,的水溶液显碱性。
(2)(进行实验)
实验 | 现象 | 结论 |
①取少量待测药品于试管中加少量水溶解,向其中加入酚酞溶液 | 溶液显红色 | 瓶内药品不可能是 |
②向实验①的试管中加入足量________ | 有气泡产生 | 瓶内药品是NaHCO3或Na2CO3 |
(3)为进一步确定瓶内药品是NaHCO3还是Na2CO3同学们按照老师的建议利用图乙所示装置进行了实验。片刻后观察到试管口有水滴,于是确定瓶中药品是NaHCO3,排除Na2CO3的理由是________。
(4)实验二:探究NaHCO3受热后的生成物
(查阅资料)①碳酸氢钠受热后生成水、一氧化碳和一种盐:②碳酸氢盐均能溶于水,其水溶液与氢氧化钙、氢氧化钡等碱反应会产生难溶物。
实验 | 现象 | 结论 |
取图20乙反应后试管中的固体少量溶于水,向其中加入足量澄清石灰水 | ________ | 碳酸氢钠受热后生成的盐是碳酸钠 |
小明对实验结果产生了质疑,他的理由是________。他按图20丙所示方案进行实验,最终得出“NaHCO3受热后生成的盐是碳酸钠”的结论。请写出加入试剂X后所发生反应的化学方程式________。
【答案】NaOH(或氢氧化钠)氯化钠、硫酸钠和硝酸钠 稀盐酸(或稀硫酸,合理即可) 碳酸钠中无氢元素,不可能生成水 产生白色沉淀 固体中有碳酸氢钠加石灰水也会产生沉淀 Na2CO3+CaCl2=2NaCl+CaCO3↓
【解析】
(1) 根据残留的标签内容,每个分子中只含有一个钠原子,因此 甲 可能是NaHCO3、Na2CO3、NaCl、Na2SO4、NaNO3中的一种, 还可能是 NaOH(或氢氧化钠)氯化钠、硫酸钠和硝酸钠 中的一种或几种;
(2) ① 滴入酚酞后,溶液变为红色,说明溶液是碱性的,因此瓶内不可能是氯化钠、硝酸钠或硫酸钠,因为上述每一种盐的溶液都是中性的;
② 由实验结论可知 瓶内药品是NaHCO3或Na2CO3 ,现象是有气泡产生 ,所以加入的物质是一种稀酸;
(3)根据反应前后元素种类不变,因为反应生成了水,说明反应前含有氢元素,而碳酸钠中没有氢元素,所以可以排除碳酸钠
(4) 碳酸氢钠受热后生成的盐是碳酸钠 ,碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,因此现象是 产生白色沉淀,碳酸氢钠和氢氧化钙也能产生白色沉淀。