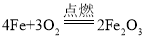题目内容
【题目】小明发现铜质水龙头表面出现了一层绿色物质,小鹏和同学们特别好奇,决定对该绿色物质进行探究。
[查阅资料]铜长期暴露在潮湿的空气中会生锈,表面有绿色物质生成,俗称铜绿,主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3。
探究一:铜在什么条件下会生锈
[提出猜想]同学们对空气中参与铜生锈的物质提出以下猜想:
猜想①:O2
猜想②:H2O
猜想③:N2
[交流讨论]经过讨论后,同学们一致认为猜想______________不合理,请解释理由_____________。
[拓展提升]除上述猜想外,你认为参与铜生锈的物质可能还有_____________。
探究二:铜绿的化学性质
[实验1]小芳同学取一定量干燥的铜绿放在试管中隔绝空气加热,如图所示。一段时间后,观察到绿色粉末逐渐变成黑色,试管口有无色液滴生成,且烧杯中的澄清石灰水变浑浊;请你用化学方程式解释澄清石灰水变浑浊的原因_______________。
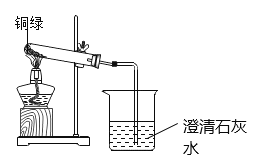
[实验2]小华同学另取一定量的铜绿于试管中,加入适量的稀盐酸,可观察到的现象是________________。
[得出结论]根据小芳、小华同学的实验,同学们总结出铜绿的化学性质为:①铜绿受热易分解;②铜绿能与稀盐酸反应。
[反思交流]同学们从安全角度考虑,认为小芳同学在结束实验1时,应该进行的操作是_______________。
[拓展应用]①小明发现不同地点收集的两个铜器(一个是纯铜做的,一个是表铜做的),纯铜器的铜绿比青铜器的少,他据此分析铜比纯铜易锈蚀,小明的分析是否全面?请你说明理由_______________。
②日常生活中为防止铜制品、铁制品的生锈,应保持其表面洁净和干燥;在金属表面涂保护层;镀一层不易生锈的金属;改变金属的组成和结构。
【答案】③ Cu2(OH)2CO3的组成中没有N元素(或根据质量守恒定律,化学反应前后元素种类不变) CO2 ![]() 固体溶解,有气泡产生,溶液变蓝色 先将导管从石灰水中移出,后熄灭酒精灯 不全面,因为不同地点空气成分含量不同,无法比较.
固体溶解,有气泡产生,溶液变蓝色 先将导管从石灰水中移出,后熄灭酒精灯 不全面,因为不同地点空气成分含量不同,无法比较.
【解析】
探究一:
[交流讨论]:
根据碱式碳酸铜的化学式Cu2(OH)2CO3可知,该物质含有Cu、C、H、O四种元素,参与铜生锈的物质没有N2不含N元素,故猜想③不合理,理由是Cu2(OH)2CO3的组成中没有N元素(或根据质量守恒定律,化学反应前后元素种类不变)。
[拓展提升]:
结合空气的成分可推测出参与铜生锈的物质还有CO2。
探究二:
[实验1]:
二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:![]() 。
。
[实验2]:
根据铜绿能与稀盐酸反应,及结合铜绿可加热分解产生二氧化碳,故可观察到的现象是固体溶解,产生气泡,溶液变蓝色。
[反思交流]:
实验1中为防止烧杯中的液体倒吸进入热的试管引起试管炸裂,实验结束时,先将导管从石灰水中移出,后熄灭酒精灯。
[拓展应用]:
①小明的分析不全面,因为不同地点空气成分含量不同,无法比较。

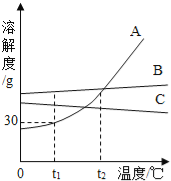
【题目】如图为实验室常见的气体制备、收集和性质的实验装置,据图回答。
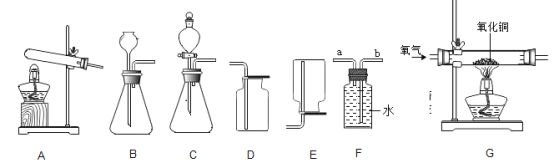
(1)推出C、D装置中标号仪器名称:X_____、Y_____。
(2)O2的制取方法有多种,若用加热氯酸钾的方法制取O2,应选用的发生装置为_____(填装置序号,下同),反应方程式为:_____。
(3)小海同学在装置B中加入15%的过氧化氢溶液和二氧化锰制取氧气。
①若用F装置收集氧气,氧气应从_____(填“a”或“b”)端通入。
②实验中发现不能得到平稳的氧气流。小涛同学提出可以从两个方面加以改进:
一是将制取的装置B换为上图中的装置_____;
二是将过氧化氢溶液加水稀释。如果在80g溶质质量分数为15%的过氧化氢溶液中加入70克水,则所得溶液的溶质质量分数为_____。
(4)实验室用加热氯化铵和氢氧化钙固体混合物制取氨气,生成氨气的化学方程式为_____,为探究氨气的性质,小红用图中G装置进行氨气与氧化铜反应的实验,实验中观察到黑色氧化铜粉末变成红色。
(提出问题)得到的红色粉末是什么?
查阅资科:Cu2O是红色,易与稀硫酸反应:![]()
(猜想假设)红色粉末是①Cu②Cu2O③_____
(设计实验)小明设计如下实验验证红色粉末中是否含有Cu2O
实验步骤 | 实验现象 | 实检站论 |
取红色粉末于试管中,加入足量稀硫酸 | _____ | 红色粉末中含有Cu2O |
(实验反思)小明设计的实验无法证明红色粉末中是否含有Cu,原因是_____。