题目内容
在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水.在工业上、实验室中可以制作氯气,用来研究氯气的性质,并将其广泛用于实际生产和生活中.
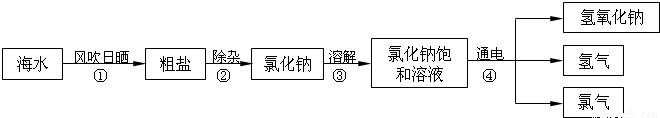
(1)在工业上,制取氯气的主要工艺流程如下:

①利用风吹日晒可以从海水中提取粗盐,该过程主要发生
②要除去食盐水中混有的少量泥沙,可选择的操作方法是
③氯化钠溶液在通电条件下发生反应的化学方程式为
(2)在实验室中,可以用加热二氧化锰和浓盐酸来制取氯气,可采用如图装置制取氯气并测量产生Cl2的体积.
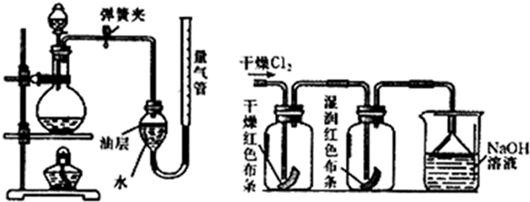
①能采用该气体发生装置的理由是
②该装置中油层的作用是
(3)氯气在常温下能分别与水、碱类等物质发生反应,并可以产生具有杀菌消毒、漂白(是有色物质褪色)等作用的物质.
①氯气与氢氧化钠溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.氯气与石灰乳反应可制漂白粉,有关化学方程式为
②氯气和水反应的原理是:Cl2+H2O=HCl+HclO.为了证明把氧气通入水的过程中,起漂白作用的物质是次氯酸(化学式为HClO),小明同学进行了如图所示的探究实验.你认为小明设计的方案能够达到目的吗?若能,请说明理由.若不能,请补充实验帮助小明达到实验目的(写出实验步骤、现象及结论).
(4)请计算:吸收14.2g氯气,需要消耗20%的氢氧化钠溶液多少克?
(1)在工业上,制取氯气的主要工艺流程如下:

①利用风吹日晒可以从海水中提取粗盐,该过程主要发生
物理
物理
(“物理”或“化学”)变化.②要除去食盐水中混有的少量泥沙,可选择的操作方法是
过滤
过滤
.③氯化钠溶液在通电条件下发生反应的化学方程式为
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
(2)在实验室中,可以用加热二氧化锰和浓盐酸来制取氯气,可采用如图装置制取氯气并测量产生Cl2的体积.

①能采用该气体发生装置的理由是
二氧化锰和浓盐酸制取氯气,需要加热
二氧化锰和浓盐酸制取氯气,需要加热
.②该装置中油层的作用是
防止氯气与水反应
防止氯气与水反应
.(3)氯气在常温下能分别与水、碱类等物质发生反应,并可以产生具有杀菌消毒、漂白(是有色物质褪色)等作用的物质.
①氯气与氢氧化钠溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.氯气与石灰乳反应可制漂白粉,有关化学方程式为
2Cl2 +2Ca(OH)2═CaCl2 +Ca(ClO)2 +2H2O
2Cl2 +2Ca(OH)2═CaCl2 +Ca(ClO)2 +2H2O
.②氯气和水反应的原理是:Cl2+H2O=HCl+HclO.为了证明把氧气通入水的过程中,起漂白作用的物质是次氯酸(化学式为HClO),小明同学进行了如图所示的探究实验.你认为小明设计的方案能够达到目的吗?若能,请说明理由.若不能,请补充实验帮助小明达到实验目的(写出实验步骤、现象及结论).
(4)请计算:吸收14.2g氯气,需要消耗20%的氢氧化钠溶液多少克?
分析:(1)利用风吹日晒从海水中提取粗盐的过程中,水不断蒸发,氯化钠的质量分数越来越大,没有学位证生成,属于物理变化;过滤可以除去不溶于水的物质;根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式.
(2)制取装置包括加热和不需加热两种,制取装置的选择与反应物的状态和反应的条件有关;本题中用加热二氧化锰和浓盐酸来制取氯气,因此需要加热.该装置中油层的作用是:防止氯气与水反应.
(3)在实验设计中,需要设计一个对照实验才能达到实验的目的,即在一个红色布条上滴加盐酸,布条无变化,就证明起漂白作用的物质是次氯酸.
(4)设出需要消耗20%的氢氧化钠溶液质量为x,根据已知条件14.2g氯气列比例式进行计算.
(2)制取装置包括加热和不需加热两种,制取装置的选择与反应物的状态和反应的条件有关;本题中用加热二氧化锰和浓盐酸来制取氯气,因此需要加热.该装置中油层的作用是:防止氯气与水反应.
(3)在实验设计中,需要设计一个对照实验才能达到实验的目的,即在一个红色布条上滴加盐酸,布条无变化,就证明起漂白作用的物质是次氯酸.
(4)设出需要消耗20%的氢氧化钠溶液质量为x,根据已知条件14.2g氯气列比例式进行计算.
解答:解:(1)①利用风吹日晒可以从海水中提取粗盐,该过程主要发生的是物理变化.故填:物理.
②若要除去食盐水中混有的少量泥沙,可选择的操作方法是过滤.故填:过滤.
③电解食盐水的化学方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;故填:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(2)①制取装置的选择与反应物的状态和反应的条件有关;本题中用加热二氧化锰和浓盐酸来制取氯气,因此需要加热.故答案为:二氧化锰和浓盐酸制取氯气,需要加热;
②氯气在常温下能分别与水、碱类等物质发生反应,并可以产生具有杀菌消毒、漂白(使有色物质褪色)等作用的物质,故答案为:防止氯气与水反应;
(3)①氯气与氢氧化钙反应生成次氯酸钙、氯化钙和水.该反应的化学方程式为:2Cl2 +2Ca(OH)2═CaCl2 +Ca(ClO)2 +2H2O;故填:2Cl2 +2Ca(OH)2═CaCl2 +Ca(ClO)2 +2H2O;
②不能达到实验的目的,需要设计一个对照实验才能达到实验的目的,即在一个红色布条上滴加盐酸,布条无变化,就证明起漂白作用的物质是次氯酸.故答案为:在一个红色布条上滴加盐酸,布条无变化,就证明起漂白作用的物质是次氯酸;
(4)解:设需要20%的氢氧化钠溶液的质量为z.
C12 +2NaOH=NaCl+NaCl0+H20
71 80
14.2g z×20%
=
z=80 g
答:需要消耗80kg 20%的氢氧化钠溶液.
故答案为:80g.
②若要除去食盐水中混有的少量泥沙,可选择的操作方法是过滤.故填:过滤.
③电解食盐水的化学方程式为:2NaCl+2H2O
| ||
| ||
(2)①制取装置的选择与反应物的状态和反应的条件有关;本题中用加热二氧化锰和浓盐酸来制取氯气,因此需要加热.故答案为:二氧化锰和浓盐酸制取氯气,需要加热;
②氯气在常温下能分别与水、碱类等物质发生反应,并可以产生具有杀菌消毒、漂白(使有色物质褪色)等作用的物质,故答案为:防止氯气与水反应;
(3)①氯气与氢氧化钙反应生成次氯酸钙、氯化钙和水.该反应的化学方程式为:2Cl2 +2Ca(OH)2═CaCl2 +Ca(ClO)2 +2H2O;故填:2Cl2 +2Ca(OH)2═CaCl2 +Ca(ClO)2 +2H2O;
②不能达到实验的目的,需要设计一个对照实验才能达到实验的目的,即在一个红色布条上滴加盐酸,布条无变化,就证明起漂白作用的物质是次氯酸.故答案为:在一个红色布条上滴加盐酸,布条无变化,就证明起漂白作用的物质是次氯酸;
(4)解:设需要20%的氢氧化钠溶液的质量为z.
C12 +2NaOH=NaCl+NaCl0+H20
71 80
14.2g z×20%
| 71 |
| 14.2g |
| 80 |
| z×20% |
z=80 g
答:需要消耗80kg 20%的氢氧化钠溶液.
故答案为:80g.
点评:解答本题要掌握化学方程式的书写方法和过滤等方面的内容,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目
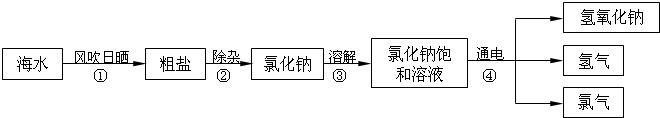
 在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水,广泛应用于实际生产和生活中。在工业上,制取氯气的主要工艺流程如下:
在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水,广泛应用于实际生产和生活中。在工业上,制取氯气的主要工艺流程如下: