题目内容
在某反应3A+B=2C+3D中,3gA恰好能和8gB完全反应,生成物中有5.4gD.若要反应生成11.2gC,则需要A的质量为 g.解答:解:根据质量守恒定律,反应3A+B=2C+3D中,3g A与8gB恰好完全反应生成5.4gD时生成C物质质量=3g+8g-5.4g=5.6g,.
设需要A的质量是x
3A+B=2C+3D
3g 5.6g
x 11.2g
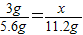
x=6g
故答案为:6;
点评:对于此类无具体反应化学方程式类根据化学方程式的计算,首先由反应中各物质的质量确定反应中物质的质量比,是解决问题的基本思路.

 名校课堂系列答案
名校课堂系列答案(2013?德宏州)一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示,下列说法中正确的是( )
|
化学中质量守恒定律是一个非常重要的定量定律。
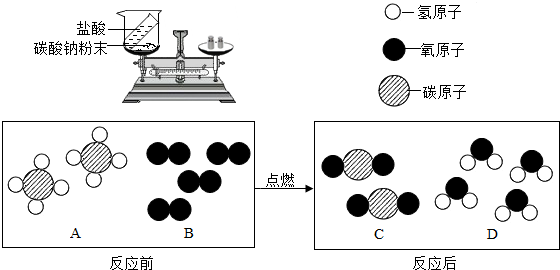
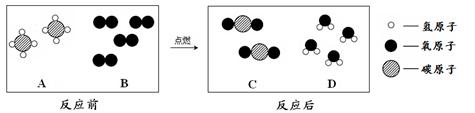
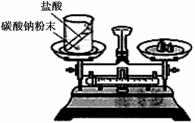
(1)如右图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为 m2,则(填“=” “>”“<”)m1 m2 ,其原因为 。
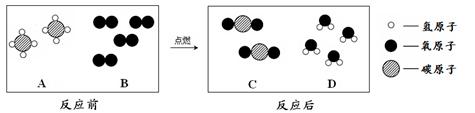
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃
料。燃烧反应前后分子种类变化的微观示意图如下所示。
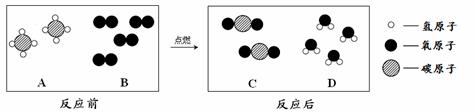
①1个B分子中含有 个原子。
②四种物质中属于化合物的是 (填图中字母)。
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量![]() 和都是l0g。有关实验数据见下表:
和都是l0g。有关实验数据见下表:
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 8g | 2g | 6g |
| ② | 4g | 6g | 6g |
| ③ | xg | yg | 9g |
X∶Y的比值可能为 或 。
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如
下:
【提出问题】样品中碳酸钠的质量分数是多少?
【知识准备】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发。
【设计方案】(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
【进行实验】甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀20.00g。
乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳。
【解决问题】请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。(写出计算过程。计算结果精确到0.1% )