题目内容
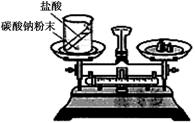
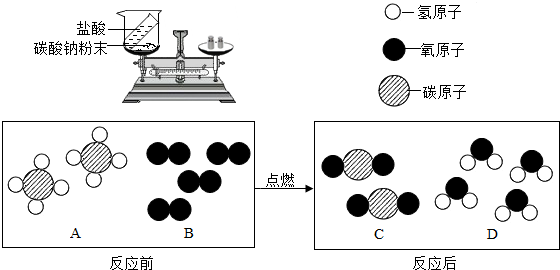
化学中质量守恒定律是一个非常重要的定量定律。(1)如下图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为 m2,则(填“=” “>”“<”)m1 m2,其原因为 。
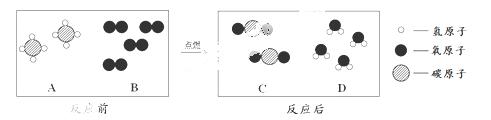
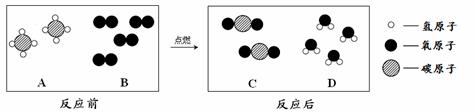
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料。燃烧反应前后分子种类变化的微观示意图如下所示。
①1个B分子中含有 个原子。
②四种物质中属于化合物的是 (填图中字母)。
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量 和都是l0g。有关实验数据见下表:
序号 反应前A的质量 反应前B的质量 反应后A3B2的质量
① 8g 2g 6g
② 4g 6g 6g
③ xg yg 9g
X∶Y的比值可能为 或 。
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
《提出问题》样品中碳酸钠的质量分数是多少?
《知识准备》食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发。
《设计方案》(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
《进行实验》甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀20.00g。
乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳。
《解决问题》请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。(写出计算过程。计算结果精确到0.1% )
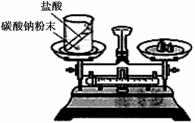
(1)> 生成的二氧化碳气体逸出,导致烧杯中物质质量减轻
(2)2 ACD (3)7:3 或3:2
(4)设样品中碳酸钠的质量为x,
Na2CO3 + Ca(OH)2==CaCO3↓+ 2NaOH
106 100
X 20g
106/100=X/20g
解得X=21.2g
21.2g/24.00g=88.3%(过程1分,格式1分,结果1分)解析:
(1)在敞口容器中做实验,生成的二氧化碳气体逸出,导致烧杯中物质质量减轻,所以m1 > m2
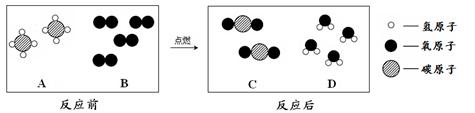
(2)B的一个分子是由2个原子构成的。化合物指的是由多种元素组成的纯净物,故选ACD
(3)每次均充分反应,从表中可以看出①时,A过量,B的2克都反应没了,生成了6克A3B2,则根据质量守恒定律可知参加反应的A的质量为4克,则参加反应的A、B质量比为2:1,第③次时,生成的A3B2为9克,根据这个比例可知A反应掉6克,B反应掉3克,还有一克剩余,这一克物质可以是A也可以是B,所以有两种可能A为7克,B为3克,或A为6克,B为4克
(4)任选一组,可以根据生成沉淀是碳酸钙20g,或者生成的气体为二氧化碳8.80g求出碳酸钠的质量。

 备战中考寒假系列答案
备战中考寒假系列答案化学中质量守恒定律是一个非常重要的定量定律。
(1)如右图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为 m2,则(填“=” “>”“<”)m1 m2 ,其原因为 。
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃
料。燃烧反应前后分子种类变化的微观示意图如下所示。
①1个B分子中含有 个原子。
②四种物质中属于化合物的是 (填图中字母)。
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量![]() 和都是l0g。有关实验数据见下表:
和都是l0g。有关实验数据见下表:
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 8g | 2g | 6g |
| ② | 4g | 6g | 6g |
| ③ | xg | yg | 9g |
X∶Y的比值可能为 或 。
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如
下:
【提出问题】样品中碳酸钠的质量分数是多少?
【知识准备】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发。
【设计方案】(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
【进行实验】甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀20.00g。
乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳。
【解决问题】请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。(写出计算过程。计算结果精确到0.1% )
 化学中质量守恒定律是一个非常重要的定量定律.右图为托盘天平,使用托盘天平称物品的正确操作顺序为(填序号)
化学中质量守恒定律是一个非常重要的定量定律.右图为托盘天平,使用托盘天平称物品的正确操作顺序为(填序号) 化学中质量守恒定律是一个非常重要的定量定律.
化学中质量守恒定律是一个非常重要的定量定律.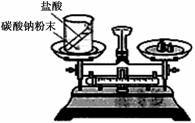 化学中质量守恒定律是一个非常重要的定量定律。
化学中质量守恒定律是一个非常重要的定量定律。