题目内容
【题目】在电缆生产过程中会产生一定量的含铜废料.据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜.
(1)请完成该反应的化学方程式2Cu+2H2SO4+O2![]() 2CuSO4+ ________
2CuSO4+ ________
(2)若选用的稀硫酸溶质的质量分数为12%,则用100 mL98%的浓硫酸(密度为1.8g/cm3)可配制该稀硫酸 ________g,需加水________ g.
【答案】2H2O;1470;1290
【解析】
(1)根据反应的化学方程式,反应物中铜、氢、硫、氧原子个数分别为2、4、2、10,反应后的生成物中铜、氢、硫、氧原子个数分别为2、0、2、8,根据反应前后原子种类、数目不变,则横线上物质的分子中共含有4个氢原子和2个氧原子,则横线上的化学式应为2H2O;(2)设需加水的质量为X,100 mL×98%×1.8g/cm3=(100 mL×1.8g/cm3+X)×12%,解得X=1290g,故若选用的稀硫酸溶质的质量分数为12%,则用100mL98%的浓硫酸(密度为1.8g/cm3)可配制该稀硫酸的质量为1290g+100mL×1.8g/cm3=1470g。

【题目】新的一年,同学们的学习方式有了很大变化。下面是《气体制取与收集》学习的课堂片段:
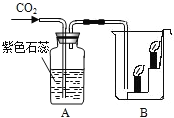
【自主学习】仿照氧气制取的学习和气体制取的一般思路,阅读课本,老师提供了几组药品,让同学们交流并选出适宜实验室制取二氧化碳的一组。
【合作交流】围绕以上问题,各小组展开了激烈的交流,下面是老师从第二小组同学交流中听到的各位学生的发言:
1号:碳酸盐用块状石灰石(主要成分碳酸钙),为什么不用纯碱(碳酸钠)呢?
3号:碳酸钠是粉未状的,反应的速度太快,不易控制,
2号:同意3号同学的说法,那我们把碳酸钠压制成块状可以吗?
各位都在思考,问题未能解决。
【展示释疑】通过各个小组的展示,大家明白了实验室制取二氧化碳应该选择石灰石和稀盐酸。
实际实验中,所用的原料或产物一般都含有杂质,在计算用料和产量时,应考虑到杂质问题。
请你帮助二组学生解决2号学生提出的问题,实验室把碳酸钠压制成块状_______(选填“可以”或“不可以”)代替石灰石制取二氧化碳。
【能力提升】某小组想测定所用石灰石样品中碳酸钙的质量分数,取用了2g的石灰石样品,把20g稀盐酸(氯化氢的水溶液)分4次加入样品中,(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶解于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入5g | 1.5g |
第二次加入5g | 1.0g |
第三次加入5g | 0.5g |
第四次加入5g | 0.3g |
(1)从以上数据可知,这四次实验中,第______次石灰石样品中碳酸钙已完全反应。
(2)求石灰石中碳酸钙的质量分数?
(3)求检测过程中所产生二氧化碳的质量?