题目内容
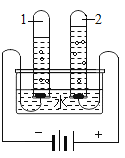
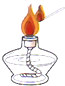
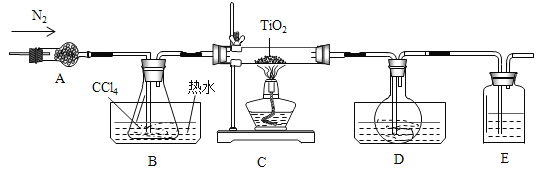
【题目】实验室利用反应:TiO2(s)+2CCl4(g)→TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置如图所示(s代表固体,g代表气体)
有关性质如下表
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
(1)装置B由水槽、橡皮塞、导管和______(填仪器名称)组成;
(2)装置A的作用是______;装置B中热水温度应_____℃;装置D水槽中的物质是_____;装置E中的试剂是______;
(3)氮气的作用是_______;反应结束时依次进行如下操作:①停止通氮气②冷却至室温③熄灭酒精灯。正确的顺序为__________(填序号);
(4)欲分离D中的液态混合物,可采取的方法是______。
【答案】锥形瓶 干燥氮气 大于76 冰水(或冷水) 浓硫酸 除去装置内的空气(或氧气) ③②① 控制温度在76℃与136℃之间,进行蒸馏(或蒸发)
【解析】
(1)装置B由水槽、橡皮塞、导管和锥形瓶组成。
(2)装置A中装的应该是碱石灰,作用是干燥氮气,因为制取过程中要求是在无水无氧条件下。由表格数据可知,CCl4的沸点是76℃,要得到CCl4气体,故装置B中热水温度应大于76℃;装置D水槽中的物质是冰水或冷水,用于冷凝TiCl4气体以及少量的CCl4气体;装置E中的试剂是浓硫酸,防止空气中的水蒸气进入装置D中,因为TiCl4遇潮湿空气产生白雾;
(3) 该实验要在无水无氧条件下进行,故氮气的作用是除去装置内的空气或氧气;反应结束时,应先熄灭酒精灯,使装置冷却至室温,再停止通氮气,防止液体倒吸,正确的顺序为③②①;
(4) D中的液态混合物有TiCl4以及少量的CCl4,根据表格中两种物质的沸点,分离D中的液态混合物,可采取的方法是控制温度在76℃与136℃之间,进行蒸馏。

【题目】浓硫酸具有强腐蚀性,将碳与浓硫酸混合加热有气体产生,小明认为产生的气体可能是CO、CO2、SO2三种气体中的一种或多种,为此进行了,下列探究:
(查阅资料)
①SO2能使品红溶液褪色,易与高锰酸钾溶液反应而被吸收,能与氢氧化钠溶液反应,能使澄清石灰水变浑浊;
②CO和CO2均不能使品红溶液褪色,也不与高锰酸钾溶液反应。
(实验探究)为验证这三种气体,小明在老师的指导下,设计并进行如图所示实验:
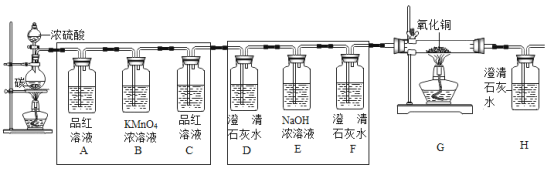
请完成如表:
实验现象 | 实验结论 |
装置A中品红溶液褪色 | 有__生成 |
__ | 有CO2生成 |
装置G中无明显现象 | __ |
(反思与评价)
(1)装置B中酸性高锰酸钾溶液的作用是__,若将装置A、D中的试剂交换,__(填“能”或“不能”)得出有CO2产生的结论。
(2)写出碳与浓硫酸反应的化学方程式__。
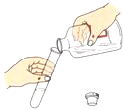
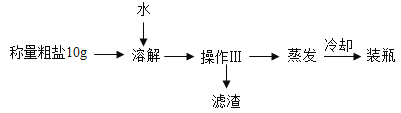
【题目】提纯含少量泥沙的粗盐样品,实验过程和氯化钠的溶解度数据如下:
温度(°C) | 溶解度(g/100g水) |
20 | 36.0 |
40 | 36.6 |
60 | 37.3 |
①操作III的名称是___________。
②溶解、蒸发均需使用玻璃棒搅拌。溶解时搅拌的目的是_________,蒸发时搅拌的目的是_____________。
③溶解时,加入水的合适的量约为30mL,如果用水量只有20mL造成的后果是_______;若用水量为50mL造成的后果是___________。