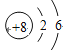题目内容
【题目】现有等质量的X、Y两种金属,分别放入浓度相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知X、Y在生成物中化合价均为+2价)。则
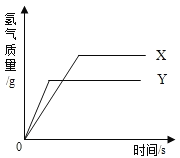
下列说法中不正确的是
A.生成氢气的质量:X﹥Y B.金属活动性:Y﹥X
C.消耗硫酸的质量:X﹥Y D.相对原子质量:X﹥Y
【答案】D
【解析】
试题分析:根据反应生成H2的质量与反应时间的关系可知,在两种金属完全反应后,放出H2的质量是X>Y;
根据金属活动性顺序,金属活动性越强的金属,与酸反应时生成氢气的速度越快,Y与酸反应比X与酸反应放出氢气的速度快,所以金属活动性顺序是Y>X,;
根据氢气中的氢元素全部来源来源于酸中的氢元素,所以生成的氢气质量多的金属消耗硫酸的质量多,即:X>Y;
根据R的化合价和化学方程式R+H2SO4=RSO4+H2↑可知,金属的相对原子质量=2×![]() ,氢气的质量越大,金属的相对原子质量越小,在金属完全反应后,放出H2的质量是X>Y,因此可判断相对原子质量是Y>X。
,氢气的质量越大,金属的相对原子质量越小,在金属完全反应后,放出H2的质量是X>Y,因此可判断相对原子质量是Y>X。

练习册系列答案
相关题目