题目内容
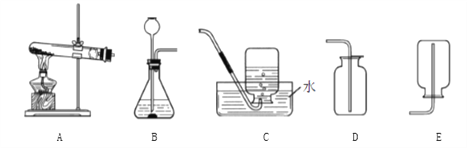
【题目】请根据下列装置图,回答有关问题:

(1)写出标号仪器的名称:①_____;②_____.
(2)实验室用高锰酸钾制取氧气,选用的发生装置是_____,反应的化学方程式为_____.
(3)实验室制取并得到干燥的二氧化碳气体,应选用的装置是_____(填字母),有关反应的化学方程式为_____.
【答案】1)①长颈漏斗 ②水槽
(2)A 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)B、E、G CaCO3+2HCl=CaCl2+H2O+CO2↑
【解析】
析:(1)①②均为实验室常用的仪器,熟记常用仪器的名称即可轻松作答.
(2)实验室制取气体的发生装置主要由反应物的状态和反应条件决定;熟记常用的化学方程式.
(3)根据反应物的状态和反应条件确定发生装置,根据气体的密度和溶水性确定收集装置,在发生装置和收集装置中间再加一个干燥气体的装置;熟记常用的化学方程式.
解答:解:(1)熟记常用仪器的名称可知①为长颈漏斗;②为水槽.
(2)反应物的状态是固态,反应条件是加热,应选固-固加热型的发生装置;高锰酸钾加热生成锰酸钾、二氧化锰和氧气.故答案为:A;2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)实验室通常用稀盐酸与大理石反应制取二氧化碳,反应物的状态是固态和液态,反应条件是常温,应选固-液不加热型的发生装置;二氧化碳的密度比空气大,能溶于水,只能用向上排空气法收集;要得到干燥的二氧化碳,在收集前应选通过E装置,浓硫酸具有吸水性,能除去二氧化碳中的水蒸汽.碳酸钙与盐酸反应生成氯化钙、水和二氧化碳.故答案为:B、E、G;CaCO3+2HCl=CaCl2+H2O+CO2↑
故答案:(1)①为长颈漏斗;②为水槽.
(2)A;2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)B、E、G;CaCO3+2HCl=CaCl2+H2O+CO2↑

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】某化学兴趣小组在做“探究纯碱的性质”实验。
探究一:同学们做了如图所示的四组实验,并将A、B、C、D四支试管中的废液全部倒入一个干净的大烧杯中。考试结束后,某兴趣小组发现大烧杯底部有沉淀,上层溶液呈红色。为了探究上层溶液的成分,进行了以下实验。
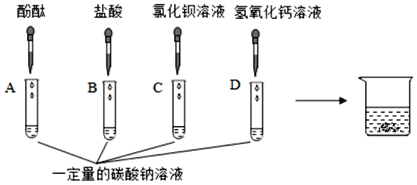
(提出问题)大烧杯中的上层溶液中除了含有水和酚酞外,还含有哪些离子?(假设难溶物质、水和酚酞均不会解离出离子)
(猜想假设)小明认为上层溶液中一定含有Na+、CO32﹣、H+、Cl﹣、Ba2+、Ca2+、OH﹣七种离子,你认为上层溶液中含有的离子最多可能有哪几种,它们分别是_____(填离子符号)。
(分析讨论)(1)小红认为上层溶液中一定不含有H+,因为上层溶液呈红色。请你分析上层溶液中不含有H+的另外一个理由_____。
(2)小李取一定量的上层溶液于试管中,滴加几滴稀盐酸,发现无气泡产生,认为上层溶液中一定不含有CO32﹣.小红认为他的结论不正确,原因是_____。
(设计实验)为进一步确定上层溶液中是否含有CO32﹣,请你和小红一起参与下列探究:
实验操作 | 实验现象 | 实验结论 |
取大烧杯中上层溶液少许于一支试管中,滴加_____,静置 | ①_____ ②试管中的上层溶液仍是红色 | ①大烧杯中上层溶液中一定含有CO32﹣ ②同时还能得出大烧杯中的上层溶液中一定含有离子是_____(填离子符号) |
(实验结论)大烧杯中的上层溶液中一定含有的离子是_____(填离子符号)。
探究二:“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行测定。
(查阅资料)碱石灰是氧化钙与氢氧化钠固体的混合物,具有良好的吸水性还能吸收酸性气体;
(设计实验)根据如图的装置,他们设计了以下实验方案进行试验。
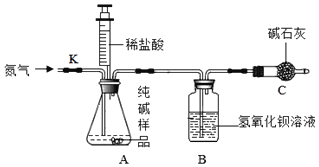
(1)如图装配好仪器,并检查装置气密性,准确称量5.0g的纯碱样品加入A中的锥形瓶,并在各装置中加入足量药品。
(2)打开止水夹K,先对装置A通入已除去氮气一会儿,再连接上装置B和C。
(3)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为_____。
(4)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入氮气一会儿。
(5)将反应后B装置内的混合物进行过滤,把获得的沉淀物进行、称量,利用沉淀物质量计算Na2CO3的质量分数。
(实验反思)
(1)实验设计中若没有装置C则本次测定的实验结果会_____(填“偏大”、“偏小”或“无影响”)
(2)老师在查看小组的实验设计后指出,该实验设计即使各步骤实验过程操作规范,测量数据准确,但最后的结果也会偏小,请你分析原因。_____。