网址:http://m.1010jiajiao.com/timu_id_4441788[举报]
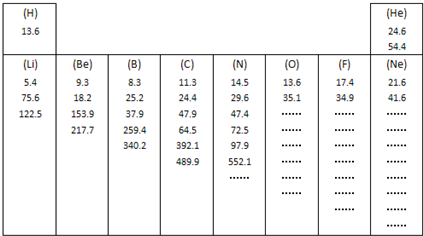
研究这些数据,回答下列问题:
(1)每组数据可能是该元素的
A.原子得到电子所放出的能量 B.原子半径的大小
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径的大小
(2)分析同周期自左向右各元素的第一个数据:
①总体变化趋势是
②与前后元素相比,由于该元素的数值增大较多而变得反常的元素位于元素周期表的
③根据你分析所得的变化规律推测,镁和铝的第一个数据的大小关系为Mg(1)
(3)分析每个元素的一组数据:
①有些元素的一组数据中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中
②根据这个规律,你认为氧元素8个数据中出现“突跃”的数据应该是第
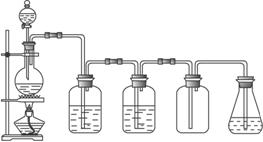
(1)在烧瓶里加热反应的试剂是下列的( )
A.硫化亚铁和稀硫酸 B.亚硫酸钠和盐酸
C.食盐固体和浓硫酸 D.二氧化锰和浓盐酸
(2)自左向右,两个洗气瓶分别装有( )
A.NaOH溶液和浓硫酸 B.水和浓硫酸
C.饱和食盐水和浓硫酸 D.水和烧碱溶液
(3)集气瓶里收集的气体是( )
A.Cl2 B.H2S C.SO2 D.HCl
查看习题详情和答案>>浓氨水可与新制生石灰作用生成氨气,干燥的氨气在高温下能被CuO氧化成N2实验室欲用图仪器装置和药品来制取纯净的氮气。

试回答下列问题:
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C……)____ ____。
(2)E中发生反应的化学方程式是____ ____。
(3)装置④中应当选用的干燥剂是(写名称)____ _______。
(4)装置①中发生氧化还原反应的化学方程式是___ ________。其中氧化剂是____ __,氧化产物是______ __(写化学式)。
(5)装置②中浓硫酸的作用是_____ ____。
查看习题详情和答案>>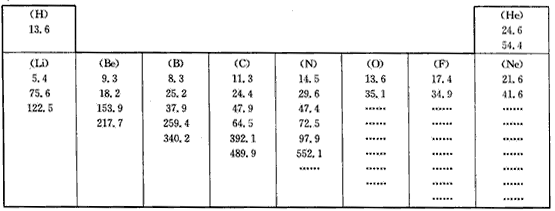
(1)每组数据可能是该元素的____(填序号)。
A.原子得到电子所放出的能量
B.原子半径的大小
C.原子逐个失去电子所吸收的能量
D.原子及形成不同分子的半径的大小
(2)分析同周期自左向右各元素原子的第一个数据:
①总体变化趋势是____(填“增大”或“减小”);
②与前后元素相比,由于该元素的数值增大较多而变得反常的元素位于元素周期表的_______族;
③根据你分析所得的变化规律推测,镁和铝的第一个数据的大小关系为Mg(1)____Al(1)(填“大 于”或“小于”)。
(3)分析每个元素的一组数据:
①有些元素的一组数据中个别数据增大的比例(倍数)特别大,形成“突跃”,由此可以证明此原子结构中 ____的结论。
②根据这个规律,你认为氧元素8个数据中出现“突跃”的数据应该是第____个。
(12分)下表是元素周期表的一部分,针对所给的11种元素,完成下列各小题。

(1)化学性质最不活泼的元素是 (填元素名称);
(2)Cl原子结构示意图为 ;
(3)第三周期元素中,最高价氧化物对应水化物碱性最强的是 (填化学式);
(4)O和N中,原子半径较大的是 ;
(5)“高钙牛奶”中的钙是指 (填“元素”或“单质”);
(6)Cl的气态氢化物的稳定性比F的气态氢化物 (填强或弱);
(7)常温下为红棕色气体的氧化物的化学式是 。
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 ;
(9)S元素形成的一种氢化物的化学式是 ,该物质中H元素与S元素的质量比
m(H):m(S)= 。(相对原子质量:H-1 S-32)
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知最不活泼的应该是稀有气体元素Ar;Cl属于第三正确第 ⅦA,所以其原子结构示意图为 ;同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。在第三周期中最活泼的金属是Na,所以氢氧化钠的碱性最强,N的原子半径大于O的原子半径;牛奶是混合物,所以“高钙牛奶”中的钙是指元素,而不是单质;同主族元素自上而下非金属性逐渐减弱,金属性逐渐增强,氯化氢的稳定性弱于氟化氢的;常温下为红棕色气体的氧化物的化学式是NO2;电解熔融氯化镁生成物是镁和氯气;S是第ⅥA,最低价是-2价,所以氢化物的化学式为H2S,其中H元素与S元素的质量比是(1×2)︰32=1︰16。
;同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。在第三周期中最活泼的金属是Na,所以氢氧化钠的碱性最强,N的原子半径大于O的原子半径;牛奶是混合物,所以“高钙牛奶”中的钙是指元素,而不是单质;同主族元素自上而下非金属性逐渐减弱,金属性逐渐增强,氯化氢的稳定性弱于氟化氢的;常温下为红棕色气体的氧化物的化学式是NO2;电解熔融氯化镁生成物是镁和氯气;S是第ⅥA,最低价是-2价,所以氢化物的化学式为H2S,其中H元素与S元素的质量比是(1×2)︰32=1︰16。
查看习题详情和答案>>