网址:http://m.1010jiajiao.com/timu_id_4437063[举报]
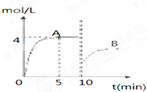 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.(1)反应到5min时,氢气反应速率
| 16 |
| (a-2)×(b-4)3 |
| 16 |
| (a-2)×(b-4)3 |
(2)在10min时采取的措施是
(3)-50°C时,液氨存在如下电离:2NH3?NH4++NH-2,K=2×10-12,往液氨中加入NH4Cl固体,K
(4)已知2A2(g)+B2(g)═2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量c kJ,a、b、c之间满足何种关系
(12分)在一定条件下,存在如下反应:2SO2(g)+ O2 (g)  2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K=
(2)升高温度,该反应K值 ,SO2转化率 ,正反
应速率 (填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 
(4)据图判断,反应进行至20min时,曲线发生变化的原因
是___________________(用文字表达),10min到15min的曲线变化的原因可能是 (填编号)。
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3物质的量 |
(1)反应到5min时,氢气反应速率 .A的平衡常数为 (用含a,b的表达式表示)
(2)在10min时采取的措施是 ;
(3)-50°C时,液氨存在如下电离:2NH3?NH4++NH-2,K=2×10-12,往液氨中加入NH4Cl固体,K 2×10-12(填“<”、“>”或“=”)
(4)已知2A2(g)+B2(g)═2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量c kJ,a、b、c之间满足何种关系 (用代数式表示)
 查看习题详情和答案>>
查看习题详情和答案>>
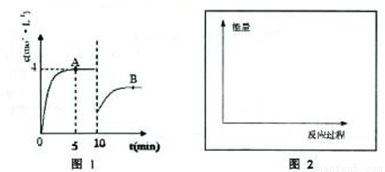
(1)反应到5min时,氢气反应速率______.
(2)在10min时采取的措施是______,A的平衡常数为______,点A的平衡常数K______(填“<”、“>”或“=”)B点的平衡常数.
(3)若合成塔内生成17g氨气放出45.5kJ热量,在图2坐标上画出该合成氨反应过程中能量随时间的变化示意图.
(4)-50°C时,液氨存在如下电离:2NH3?NH4++NH-2,k=2×10-2,液氨的电离达到平衡时,各微粒的浓度大小关系为______,加入NH4Cl固体,K______2×10-12(填“<”、“>”或“=”)
查看习题详情和答案>>
在一定条件下,存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K=________
(2)升高温度,该反应K值________,SO2转化率________,正反应速率________(填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是________

(4)据图判断,反应进行至20 min时,曲线发生变化的原因是________(用文字表达),10 min到15 min的曲线变化的原因可能是________(填编号).
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3物质的量
(5)在25℃下,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________.
)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________.