网址:http://m.1010jiajiao.com/timu_id_4435142[举报]
方法二 实验过程:分别取同温、同压、等体积的X2和Y2两种气体充入一恒容的密闭容器中,并测定容器的压强(p1),在一定条件下反应完全并恢复到原温度后,再测定容器的压强(p2)结论及分析
方法二 实验过程:分别取同温、同压、等体积的X2和Y2两种气体充入一恒容的密闭容器中,并测定容器的压强(p1),在一定条件下反应完全并恢复到原温度后,再测定容器的压强(p2)结论及分析
结论及分析:
(1)若实验结果是
②p2=p1 X2+Y2═2XY,反应前后分子数之比是1:1,根据阿伏加德罗定律可推得以上结论;
②p2=p1 X2+Y2═2XY,反应前后分子数之比是1:1,根据阿伏加德罗定律可推得以上结论;
相同温度相同体积下,气体的分子数之比等于其计量数之比;
相同温度相同体积下,气体的分子数之比等于其计量数之比;
(2)若实验结果是
| 3 |
| 4 |
②p2=
| 3 |
| 4 |
| 3 |
| 4 |
②p2=
| 3 |
| 4 |
相同温度相同体积下,气体的分子数之比等于其计量数之比;
相同温度相同体积下,气体的分子数之比等于其计量数之比;
I、二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl更好。
⑴ 在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是 。
⑵ 用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。
饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I—还原为ClO2—、Cl—的转化
率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2—也能被I—完全还原为Cl—。反应生成
的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
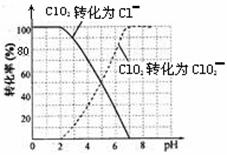 ①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4: 加入少量淀粉溶液,用c mol·L-1Na2S2O3
溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为 mol·L-1(用含字母的代数式表示)。
II.(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

⑴ 在农业生产中,滤液1可用作 。
⑵ 流程中生成高铁酸钾的离子方程式是: ,控制此反应温度30℃以下的原因是: 。
⑶结晶过程中加入浓KOH溶液的作用是: 。
⑷某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
⑸实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 附近、反应时间应控制在 。

氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域中有重要用途.
Ⅰ.工业上有多种方法来制备氮化硅,常见的方法:
方法一 直接氮化法:在1 300~1 400℃时,高纯粉状硅与纯氮气化合,其反应方程式为______.
方法二 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是______.
方法三 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si3N4和一种气体______(填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为______.
Ⅱ.(1)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,此盐中存在的化学键类型有______.
(2)已知:25℃,101kPa条件下的热化学方程式:
3Si(s)+2N2(g)═Si3N4(s)△H=-750.2kJ/mol ①
Si(s)+2C12(g)═SiCl4(g)△H=-609.6kJ/mol ②
 H2(g)+
H2(g)+ C12(g)═HCl(g)△H=-92.3kJ/mol ③
C12(g)═HCl(g)△H=-92.3kJ/mol ③
请写出四氯化硅气体与氮气、氢气反应的热化学方程式:______.
Ⅲ.工业上制取高纯硅和四氯化硅的生产流程如下:
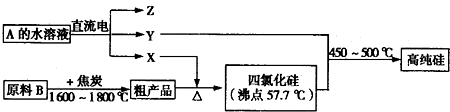
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是______(填化学式).
(2)写出焦炭与原料B中的主要成分反应的化学方程式:______.
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu?______(填“能”或“不能”).写出Cu为阳极电解A的水溶液开始一段时间阴、阳极的电极反应方程式.阳极:______;阴极:______.
查看习题详情和答案>>
各物质的沸点与压强的关系见右表.
| 压强(kPa) | 13.33 | 53.32 | 101.3 |
| K的沸点(℃) | 590 | 710 | 770 |
| Na的沸点(℃) | 700 | 830 | 890 |
| KCl的沸点(℃) | 1437 | ||
| NaCl的沸点(℃) | 1465 |
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是(只要求写二种方法)
实验一:取mg该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g,装置D增重0.44g.

(1)装置C和D中盛放的药品是:C
(2)实验开始前先通入一段时间空气,其目的是
实验二:另取m g该药片,加入100mL1mol/L的稀硫酸,充分反应后滤去不溶物,向滤液中逐渐加入1mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
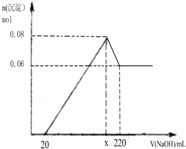
(3)根据以上所给数据求出x=
(4)通过计算确定铝碳酸镁的化学式为
(5)有医生建议患有严重胃溃疡的患者最好慎用该药,试用你所学的知识解释这样建议的理由是
(6)有同学认为,不需要做实验一,只需要在实验二的基础上再得知两个数据就可以求出铝碳酸镁的化学式,你认为这两个数据应该是: