摘要:受热易分解:NH4Cl NH3 ↑+HCl↑ NH4HCO3NH3 ↑ +CO2 ↑ +H2O
网址:http://m.1010jiajiao.com/timu_id_4435064[举报]
已知A为常见金属,常温下X、E、F为气体,C为液体.B是一种盐,受热易分解,冷却时分解产物又能化合生成B,B在工农业生产中有着广泛的用途.有关物质之间的转化关系如图(其中有些反应的条件及部分生成物被略去):
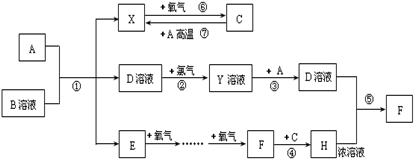
请回答下列问题:
(1)写出物质B的电子式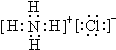
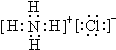 ;
;
(2)比较①~⑦七个反应,请归纳它们的共同特点是
(3)写出反应⑦的化学方程式
(4)写出过量A与H浓溶液反应的离子方程式
(5)D是实验中常用的物质,检验D是否变质的方法是:
查看习题详情和答案>>

请回答下列问题:
(1)写出物质B的电子式
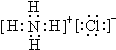
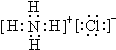
(2)比较①~⑦七个反应,请归纳它们的共同特点是
均为氧化还原反应
均为氧化还原反应
;(3)写出反应⑦的化学方程式
3Fe+4H2O
Fe3O4+4H2↑
| ||
3Fe+4H2O
Fe3O4+4H2↑
;
| ||
(4)写出过量A与H浓溶液反应的离子方程式
Fe+4H++2NO3-=Fe2++2NO2↑+2H2O
Fe+4H++2NO3-=Fe2++2NO2↑+2H2O
;(5)D是实验中常用的物质,检验D是否变质的方法是:
取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质
取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质
.(2013?漳州二模)钛铁矿的主要成分为FeTiO3(可表示为FeO?TiO2),含有少量MgO、CaO、SiO2等杂质.利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是
(2)滤渣A的成分是
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示.反应温度过高时,Ti元素浸出率下降的原因是

(5)反应③的化学方程式是
(6)由滤液D制备LiFePO4的过程中,所需 17%双氧水与H2C2O4的质量比是
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4?
+3FePO4该电池充电时阳极反应式是
查看习题详情和答案>>

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是
+2
+2
.(2)滤渣A的成分是
SiO2
SiO2
.(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是
TiOCl42-+H2O=TiO2↓+2H++4Cl-
TiOCl42-+H2O=TiO2↓+2H++4Cl-
.(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示.反应温度过高时,Ti元素浸出率下降的原因是
温度过高时,反应物氨水(或双氧水)受热易分解
温度过高时,反应物氨水(或双氧水)受热易分解
.
(5)反应③的化学方程式是
(NH4)2Ti5O15+2 LiOH=Li2Ti5O15↓+2NH3?H2O(或2NH3+2H2O)
(NH4)2Ti5O15+2 LiOH=Li2Ti5O15↓+2NH3?H2O(或2NH3+2H2O)
.(6)由滤液D制备LiFePO4的过程中,所需 17%双氧水与H2C2O4的质量比是
20:9
20:9
.(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4?
| ||
| 放电 |
LiFePO4-e-=FePO4+Li+
LiFePO4-e-=FePO4+Li+
.A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
(3)A、B、D、E四种元素组成的某无机化合物浓度为0.1mol/L时,pH最接近
A.5.6B.7.0 C.8.4D.13.0
(4)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g)
2CA3(g)
△H=-92.4kJ?mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2mol,总容积为1.0L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是
A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
②求算此平衡体系的平衡常数K=
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将
④已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65kJ的热量.写出该反应的热化学方程式
查看习题详情和答案>>
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
10-4:1
10-4:1
.(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
Ba2++HCO3-+OH-═BaCO3↓+H2O
Ba2++HCO3-+OH-═BaCO3↓+H2O
.(3)A、B、D、E四种元素组成的某无机化合物浓度为0.1mol/L时,pH最接近
C
C
.A.5.6B.7.0 C.8.4D.13.0
(4)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)
 2CA3(g)
2CA3(g)△H=-92.4kJ?mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2mol,总容积为1.0L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是
BC
BC
:A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
②求算此平衡体系的平衡常数K=
10
10
;③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将
逆向
逆向
(填“正向”、“逆向”或“不”)移动.理由是原平衡体系中,1.0L容器中含有分子0.5mol+0.2mol+0.2mol=0.9mol,当加入N2,体系瞬间有分子0.9mol+0.18ml=1.08mol,瞬间总体积为1.08×
=1.2L,所以:Q=
=
=10.59>10,平衡逆向移动
| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
原平衡体系中,1.0L容器中含有分子0.5mol+0.2mol+0.2mol=0.9mol,当加入N2,体系瞬间有分子0.9mol+0.18ml=1.08mol,瞬间总体积为1.08×
=1.2L,所以:Q=
=
=10.59>10,平衡逆向移动
.| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
④已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65kJ的热量.写出该反应的热化学方程式
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ?mol-1
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ?mol-1
.在一定条件下可实现图所示物质之间的变化:

请填写以下空白:
(1)孔雀石的主要成分是Cu2(OH)2CO3,受热易分解,如图中的F是(写化学式)
 .
.
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:
(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的反应方程式:
(4)每生成1个D,同时生成
个E.
(5)D与NaOH溶液反应的化学反应方程式为(用单桥式标出电子转移的方向及数目)
 .
.
查看习题详情和答案>>

请填写以下空白:
(1)孔雀石的主要成分是Cu2(OH)2CO3,受热易分解,如图中的F是(写化学式)
CO2
CO2
.其相应的电子式是

(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的反应方程式:
3CuO+2Al
3Cu+Al2O3
| ||
3CuO+2Al
3Cu+Al2O3
.
| ||
(4)每生成1个D,同时生成
| 3 |
| 4 |
| 3 |
| 4 |
(5)D与NaOH溶液反应的化学反应方程式为(用单桥式标出电子转移的方向及数目)

