网址:http://m.1010jiajiao.com/timu_id_4434990[举报]
| |||||||||||||||||||||||||||||||
方法甲:取2药匙细小的硫酸铜晶体置于
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
[交流与讨论]
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是
(2)方法乙中,浓硫酸的作用是
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想
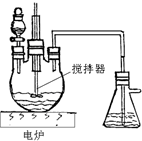
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4?5H2O的新工艺.模拟制备装置如右图所示.
[问题一]如图装置中,分液漏斗内装的液体是
[问题二]工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品--亚硝酸钙.尾气吸收生成亚硝酸钙的化学方程式是
(12分)某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动。
【提出问题】这种淡黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是淡黄色粉末,不溶于水;②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成碱和一种气体;在呼吸面具中和潜水艇里常用作供氧剂。
【猜想与探究】猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物。
探究:过氧化钠与水反应的生成物的成分。
【实验与结论】
| | 实验操作 | 实验现象 | 实验结论 |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | _____________________ | 猜想a、c不成立,猜想b成立。 |
| 探究 | ①用带火星的木条伸入过氧化钠与水反应的试管中 | 木条复燃 | 生成物有___________ |
| ②往①试管内的溶液中滴加___________ ______________ | _____________________ | 生成物有氢氧化钠 |

于是设计上图所示的装置继续实验探究。
| 实验操作 | 实验现象 | 实验结论 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为: ____________________________ |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的氢气通入澄清石灰水中 | 有气泡产生 石灰水变浑浊 |
(12分)某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动。
【提出问题】这种淡黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是淡黄色粉末,不溶于水;②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成碱和一种气体;在呼吸面具中和潜水艇里常用作供氧剂。
【猜想与探究】猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物。
探究:过氧化钠与水反应的生成物的成分。
【实验与结论】
|
|
实验操作 |
实验现象 |
实验结论 |
|
猜想 |
在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 |
_____________________ |
猜想a、c不成立,猜想b成立。 |
|
探究 |
①用带火星的木条伸入过氧化钠与水反应的试管中 |
木条复燃 |
生成物有___________ |
|
②往①试管内的溶液中滴加___________ ______________ |
_____________________ |
生成物有氢氧化钠 |
【继续探究】小组对过氧化钠能作为供氧剂也很感兴趣,大家讨论认为可能是CO2在常温下能与过氧化钠反应有关,

于是设计上图所示的装置继续实验探究。
|
实验操作 |
实验现象 |
实验结论 |
|
①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 |
木条复燃 |
CO2在常温下能与过氧化钠反应,该反应的化学方程式为: ____________________________ |
|
②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的氢气通入澄清石灰水中 |
有气泡产生 石灰水变浑浊 |
【交流与比较】与我们学过的制氧气方法相比,常选用过氧化钠作为呼吸面具和潜水艇的供氧剂的一个理由是: ________________________________。
查看习题详情和答案>>
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
8Fe+30HNO3(更稀)=8Fe(NO3)3+3NH4NO3+9H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验

⑵ 上述实验 说明黑色粉末X中含有______________ 。
II.定量测定根据下图所示的实验方案进行实验并记录数据:

⑵通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为____________。
[交流讨论] 在实验过程中,发现在溶液Y中滴加过量NaOH溶液时有刺激性气味气体生成。为了确定溶液Y中各离子浓度,甲同学重复上述实验。在步骤①中共收集到标准状况下896mL的气体,经分析其中只含有NO;测得溶液Y中c(H+)=0.5mol/L。通过计算可知,溶液Y中c(Fe3+)=__________mol/L,c(NH4+)=___________mol/L,c(NO3-)=___________mol/L。请画出在200mL溶液Y中加入NaOH物质的量与生成的Fe(OH)3沉淀物质的量的关系曲线。

