摘要: 试剂:氯气. 铁丝 铜丝 氢气 [活动内容]
网址:http://m.1010jiajiao.com/timu_id_4434880[举报]
| |||||||||||||||||||||||||||||
已知:溴的水溶液呈黄色,溴的四氯化碳溶液呈橙红色.在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色.
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是 (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是 .
(2)现提供如下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
实验证明乙同学的推断是正确的,请用三种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
(3)根据上述实验推测,若在稀溴化亚铁溶液中通人氯气,首先被氧化的离子是 ,写出在稀溴化亚铁溶液中通人足量氯气时的离子方程式: .
查看习题详情和答案>>
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是
(2)现提供如下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
实验证明乙同学的推断是正确的,请用三种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.
(1)测得某废腐蚀液中含CuCl2 1.5mol?L-1、FeCl23.0 mol?L-1、FeCl3 1.0mol?L-1、HCl3.0mol?L-1.取废腐蚀液200mL按如下流程在实验室进行实验:
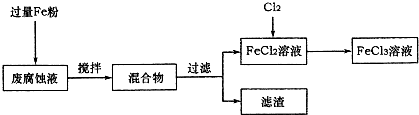
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为
②检验废腐蚀液中含有Fe3+的实验操作是
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、
③由滤渣得到纯铜,除杂所需试剂是
(2)某化学兴趣小组利用如图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.
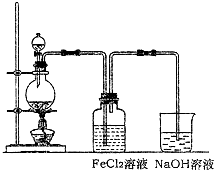
①实验开始前,某同学对实验装置进行了气密性检查,方法是
②浓盐酸与二氧化锰反应的化学方程式为
烧杯中NaOH溶液的作用是
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于
查看习题详情和答案>>
(1)测得某废腐蚀液中含CuCl2 1.5mol?L-1、FeCl23.0 mol?L-1、FeCl3 1.0mol?L-1、HCl3.0mol?L-1.取废腐蚀液200mL按如下流程在实验室进行实验:

回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑
;②检验废腐蚀液中含有Fe3+的实验操作是
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
;在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、
漏斗
漏斗
.③由滤渣得到纯铜,除杂所需试剂是
盐酸
盐酸
.(2)某化学兴趣小组利用如图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.

①实验开始前,某同学对实验装置进行了气密性检查,方法是
关闭分液漏斗活塞,将导管插入水中,用手捂热烧瓶,导管口有气泡冒出,松开手导管内出现一段水柱,证明气密性良好
关闭分液漏斗活塞,将导管插入水中,用手捂热烧瓶,导管口有气泡冒出,松开手导管内出现一段水柱,证明气密性良好
.②浓盐酸与二氧化锰反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
烧杯中NaOH溶液的作用是
吸收多余氯气,防止尾气处理
吸收多余氯气,防止尾气处理
.③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于
39.2
39.2
g,需通入Cl2的物质的量应不少于0.75
0.75
mol. CuCl2+2FeCl2
CuCl2+2FeCl2