摘要:(二)晶胞 1.晶胞的定义:晶体结构中的基本单元叫晶胞. (1)晶胞是从晶体结构中截取出来的大小.形状完全相同的平行六面体.晶胞代表整个晶体.无数个晶胞堆积起来.则得到晶体. (2)整个晶体是由晶胞“无隙(相邻晶胞之间没有任何间隙)并置(所有晶胞都是平行排列的.取向相同) 堆砌而成.晶胞的无隙并置体现了晶体的各向异性和紧密堆积(紧密堆积指由无方向性的金属键.离子键和范德华力等结合的晶体中.原子.离子或分子等微观粒子总是趋向于相互配位数高.能充分利用空间的堆积密度最大的那些结构.). (3)晶胞内微粒的组成反映整个晶体的组成.求出晶胞中微粒的个数比就能写出晶体的化学式. 2.晶胞中原子个数的计算方法:
网址:http://m.1010jiajiao.com/timu_id_4430313[举报]
 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
(1)T的基态原子的价电子排布式为
(2)U、V两种元素可组成多种结构的分子.请写出符合下列条件的物质的结构简式:
若化合物V8U8中V元素均采取sp3杂化方式
若化合物V8U8中V元素均采取sp2杂化方式
(3)写出一种与V22-互为等电子体的分子的化学式为
(4)甲和乙分别是W、X元素对应的氢化物,甲和乙中均属于10电子分子,甲极易溶于乙中,原因是
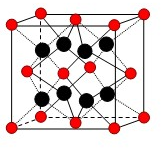
(5)ZY2晶体的晶胞如图所示,Z2+位于晶胞的顶点和面心,则Z2+的配位数为