网址:http://m.1010jiajiao.com/timu_id_4411514[举报]
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2 SO2(g)+O2 (g)2SO3(g) △H=-196.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| SO2 | O2 | SO3 | ||
| ① | 2 | 1 | 0 | 放出热量a kJ |
| ② | 1 | 0.5 | 1 | 放出热量b kJ |
| ③ | 4 | 2 | 0 | 放出热量c kJ |
下列叙述正确的是
A.放出热量关系:a = b B.三个容器内反应的平衡常数:③>②>①
C.平衡时SO3气体的体积分数:③>① D.SO2的转化率:②>①>③
【解析】平衡的建立和途径无关,所以②中相当于是2molSO2和1molO2,即①②中的平衡是等效的。但在反应过程中实际消耗的氧气是不相同的,所以a不等于b。温度相同,平衡常数就相同,B不正确。③相当于增大压强,平衡向正反应方向移动,所以SO2的转化率增大,SO3的体积分数也增大。因此正确的答案是C。
查看习题详情和答案>>
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2 SO2(g)+O2 (g) 2SO3(g)
△H=-196.4 kJ/mol。
2SO3(g)
△H=-196.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
|
容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
|
SO2 |
O2 |
SO3 |
||
|
① |
2 |
1 |
0 |
放出热量a kJ |
|
② |
1 |
0.5 |
1 |
放出热量b kJ |
|
③ |
4 |
2 |
0 |
放出热量c kJ |
下列叙述正确的是
A.放出热量关系:a = b B.三个容器内反应的平衡常数:③>②>①
C.平衡时SO3气体的体积分数:③>① D.SO2的转化率:②>①>③
【解析】平衡的建立和途径无关,所以②中相当于是2molSO2和1molO2,即①②中的平衡是等效的。但在反应过程中实际消耗的氧气是不相同的,所以a不等于b。温度相同,平衡常数就相同,B不正确。③相当于增大压强,平衡向正反应方向移动,所以SO2的转化率增大,SO3的体积分数也增大。因此正确的答案是C。
查看习题详情和答案>>
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)-4C(g) ΔH>0达到平衡时,c(A)=2 mol/L,c(B)=7 mol/L,c(C)=4 mol/L.试确定B的起始浓度c(B)的取值范围是________若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是________.
A、增加C的物质的量
B、加压
C、升温
D、使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈________性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO![]() 水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
________________
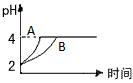
(3)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化.如图所示.则图中表示醋酸溶液中pH变化曲线的是________
(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1________m2(选填“<”、“=”、“>”)
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g)
 4C(g) △H >0 达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是____________若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是_____________
4C(g) △H >0 达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是____________若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是_____________ A、增加C的物质的量 B、加压 C、升温 D、使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。则该溶液呈________性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32-水解所至。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)______________________________________
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化 如图所示。则图中表示醋酸溶液中pH变化曲线的是_________(填A或B)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1________m2 (选填“<”、“=”、“>”)
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图.

①写出工业上合成氨的化学方程式
| ||
| 高温高压 |
| ||
| 高温高压 |
②图A中氨气的体积分数为15.00%时,H2的转化率=
③图B中T=500°C,温度为4500C对应的曲线是
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O
 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
| 时间/min | CH4(mol) | H20( mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
前5min平均反应速率v(CH4)=
②反应在7~10min之间,CO的物质的量减少的原因可能是
a?减少CH4 b?降低温度c?增大压强d?充入H2
③若保持温度不变,向1L容器中起始充入0.15mol CH4.0.45mol H2O.