摘要:D 2.C
网址:http://m.1010jiajiao.com/timu_id_4406101[举报]
Ⅰ、保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处.
(1)pH<
(2)对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为
(3)获得洁净安全的饮用水是每个人的正常需要.某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为
Ⅱ、(1)下列常用物质:A.碳酸镁 B.阿斯匹林 C.葡萄糖 D.苯甲酸钠 E.柠檬黄(请用字母填空)
具有解热镇痛疗效的是
(2)①氢氧化铝,小苏打均可防治胃酸分泌过多,其发挥功效时的化学方程式
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)
③发育出现障碍,患营养缺乏症,这主要是由于摄入蛋白质不足引起的.蛋白质在人体内水解的最终产物是
查看习题详情和答案>>
(1)pH<
5.6
5.6
的雨水称为酸雨;向煤中加入适量的生石灰
生石灰
,可以大大减少燃物产物中SO2的量.(2)对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为
2CO+2NO
2CO2+N2
| ||
2CO+2NO
2CO2+N2
.
| ||
(3)获得洁净安全的饮用水是每个人的正常需要.某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
.Ⅱ、(1)下列常用物质:A.碳酸镁 B.阿斯匹林 C.葡萄糖 D.苯甲酸钠 E.柠檬黄(请用字母填空)
具有解热镇痛疗效的是
B
B
,可直接进入人体血液补充能量的是C
C
,可用作食品防腐剂的是D
D
,常用作食品着色剂的是E
E
,常用作治疗胃酸过多的抗酸剂的是A
A
.(2)①氢氧化铝,小苏打均可防治胃酸分泌过多,其发挥功效时的化学方程式
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3HCl=AlCl3+3H2O
;NaHCO3+HCl=NaCl+CO2↑+H2O
NaHCO3+HCl=NaCl+CO2↑+H2O
.②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)
C6H12O6
C6H12O6
.③发育出现障碍,患营养缺乏症,这主要是由于摄入蛋白质不足引起的.蛋白质在人体内水解的最终产物是
氨基酸
氨基酸
.C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系:
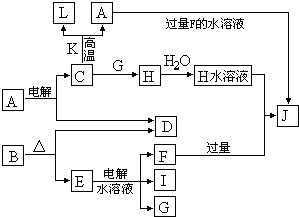
请填空:
(1)D与I能形成原子个数比为1:1的共价化合物,请写出其分子式:
G与I也能形成原子个数比为1:1的共价化合物,请写出其电子式: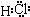
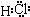 .
.
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解1L1mol?L-1的E水溶液的化学方程式:
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%.反应C→L的化学方程式是
(4)写出A+F→J的离子方程式:
查看习题详情和答案>>

请填空:
(1)D与I能形成原子个数比为1:1的共价化合物,请写出其分子式:
H2O2
H2O2
;G与I也能形成原子个数比为1:1的共价化合物,请写出其电子式:
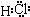
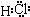
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解1L1mol?L-1的E水溶液的化学方程式:
2KCl+2H2O
2KOH+Cl2↑+H2↑
| ||
2KCl+2H2O
2KOH+Cl2↑+H2↑
,当溶液的pH=13时,理论上生成G的单质在标准状况下的体积为
| ||
1.12L
1.12L
;若将上述两电极材料调换,则阳极上的电极反应为Fe-2e-=Fe2+
Fe-2e-=Fe2+
.(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%.反应C→L的化学方程式是
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
| ||
(4)写出A+F→J的离子方程式:
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
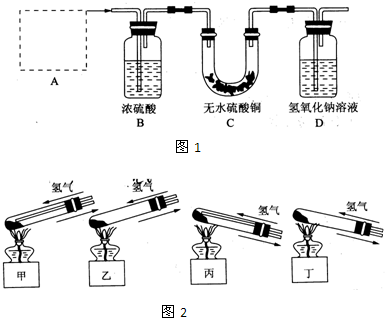
.Ⅰ、铜器长期暴露在潮湿空气中,它的表层往往含有“铜绿”(碱式碳酸铜),它受热易分解,为了从铜绿中制得铜,并测定铜绿在混合物中的质量分数,把铜绿样品放在试管中,与通入的纯净氢气在加热条件下发生反应,实验装置如图1,请回答下列有关问题.
(1)A处应选用图2装置中的(填写编号)
(2)反应开始前,对整个实验装置必须进行的操作是称量样品质量、检查装置的气密性和
(3)要测定铜绿在混合物中的质量分数,除需要知道样品质量外还需测定的实验数据是实验前后装置D质量.
(4)为使实验更准确,可采取的措施是
Ⅱ、10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则
A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言
查看习题详情和答案>>
(1)A处应选用图2装置中的(填写编号)
丙
丙
(铁架台已省去),选用的理由是①因反应有水生成,试管口应略低于试管底部,防止冷凝水倒流到试管底部而使试管炸裂
因反应有水生成,试管口应略低于试管底部,防止冷凝水倒流到试管底部而使试管炸裂
;②通入氢气的导气管应伸入到试管底部,有利于将试管中的空气排净.
(2)反应开始前,对整个实验装置必须进行的操作是称量样品质量、检查装置的气密性和
称量装置D(含氢氧化钠溶液)的质量
称量装置D(含氢氧化钠溶液)的质量
;反应进行时,应先通氢气
通氢气
再加热
加热
;实验过程中,观察到试管中固体颜色变化为固体由绿色变黑色,最后变成光亮的红色
固体由绿色变黑色,最后变成光亮的红色
.(3)要测定铜绿在混合物中的质量分数,除需要知道样品质量外还需测定的实验数据是实验前后装置D质量.
(4)为使实验更准确,可采取的措施是
在D装置后加一个盛有碱石灰的球形干燥管
在D装置后加一个盛有碱石灰的球形干燥管
.Ⅱ、10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
.乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于
大于
(填“大小”或“小于”)NaHCO3.丙同学认为甲、乙的判断都不充分.丙认为:(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则
乙
乙
(填“甲”或“乙”)判断正确.试剂X是B
B
(填序号).A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则
甲
甲
(填“甲”或“乙”)判断正确.(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言
乙
乙
(填“甲”或“乙”)判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
常压下加热NaHCO3的水溶液,溶液的温度达不到150℃
. 、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL80%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应.
回答下列问题:
(1)该实验制取溴乙烷的化学方程式为:
NaBr+H2SO4+C2H5OH
NaHSO4+C2H5Br+H2O
| △ |
NaBr+H2SO4+C2H5OH
NaHSO4+C2H5Br+H2O
| △ |
(2)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为
Br2
Br2
,同时还生成另一种无色气体.(3)U型管内可观察到的现象是
有油状液体生成
有油状液体生成
.(4)反应结束后,U形管中粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的
C
C
(填字母)A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
所需的主要玻璃仪器是
分液漏斗
分液漏斗
(填仪器名称).要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行蒸馏
蒸馏
(填操作名称).(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后
④①⑤③②
④①⑤③②
(填代号).①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
(6)溴乙烷(C2H5Br)多一个碳的同系物所有可能的物质在氢氧化钠的醇溶液中能发生反应,写出该反应的化学方程式
CH3CH2CH2Br+NaOH
CH3CH=CH2+NaBr+H2O
| 醇 |
| △ |
CH3CH2CH2Br+NaOH
CH3CH=CH2+NaBr+H2O
,| 醇 |
| △ |
CH3CHBrCH3+NaOH
CH3CH=CH2+NaBr+H2O
| 醇 |
| △ |
CH3CHBrCH3+NaOH
CH3CH=CH2+NaBr+H2O
.| 醇 |
| △ |

Ⅰ、(1)在某容积为10L的密闭容器中,有可逆反应:
mA(g)+nB(g)?pC(g)+qD(s)△H<0.
如图1为某反应过程中各物质物质的量n(mol)随时间t(min)的变化曲线图.
①在0~15min内的平均反应速率:v(B)=
0.01mol/(L?min)
0.01mol/(L?min)
.②该反应的平衡常数表达式为
| c2(C) |
| c(A)×c3(B) |
| c2(C) |
| c(A)×c3(B) |
③下列哪些物理量不再变化时可以表明该反应已经到达平衡状态
a
a
(填字母,多选、少选均扣分)a.混合气体的压强 b.混合气体的密度
c.混合气体的总体积 d.c(A)与c(B)的比值
(2)若该反应的正反应速率与时间的关系如图2所示.在其他条件不变的情况下,t2时改变的条件可能是
降低温度
降低温度
;Ⅱ、(1)常温下,0.1mol?L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
BD
BD
(填序号) A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)?c(OH-) D.c(OH-)/c(H+)
(2)体积均为100mLpH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图3所示,则Ka(HX)
大于
大于
(填“大于”、“小于”或“等于”)Ka(CH3COOH).(3)23℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中离子浓度大小关系是
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
,c(CH3COO-)/c(CH3COOH)=18
18
. (已知醋酸的电离平衡常数Ka=1.8×10-5)